
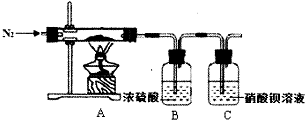
 硫酸亞鐵銨又稱為摩爾鹽,是一種重要的化工原料,其組成可表示為x(NH4)2S04•yFeS04•zH20.某興趣小組探究組成中的x、y、z的數值.
硫酸亞鐵銨又稱為摩爾鹽,是一種重要的化工原料,其組成可表示為x(NH4)2S04•yFeS04•zH20.某興趣小組探究組成中的x、y、z的數值.分析 (1)由于亞鐵離子能被空氣中的氧氣氧化,樣品要在隔絕空氣條件下分解,所以實驗前要通入N2可以將裝置中的空氣排盡,為使反應產生的氣體充分被吸收,實驗結束時還在通一會兒氮氣,C中硝酸鋇能氧化二氧化硫,生成硫酸鋇和一氧化氮,據此答題;
(2)根據過濾操作可知,所用到的玻璃儀器有玻璃棒、燒杯、漏斗,硫酸鋇沉淀在氯化鋇沉淀中析出,可以通過檢驗沉淀表面是否有氯離子或鋇離子判斷沉淀是否洗凈;
(3)滴定過程中亞鐵離子被高錳酸鉀氧化成鐵離子,滴定終點時,溶液中出現紫紅色;
(4)根據實驗原理可知,根據步驟Ⅱ產生硫酸鋇沉淀的質量可計算出硫酸根離子的物質的量,根據步驟Ⅲ用去的高錳酸鉀的物質的量可計算出亞鐵離子的物質的量,根據電荷守恒可確定銨根離子的物質的量,根據B裝置的質量變化可知反應生成氨氣和水的質量,進而確定水的物質的量,據此確定化學式.
解答 解:(1)由于亞鐵離子能被空氣中的氧氣氧化,樣品要在隔絕空氣條件下分解,所以實驗前要通入N2可以將裝置中的空氣排盡,為使反應產生的氣體充分被吸收,實驗結束時還在通一會兒氮氣,C中硝酸鋇能氧化二氧化硫,生成硫酸鋇和一氧化氮,反應的離子方程式為3Ba2++3SO2+2NO3-+2H2O═3BaSO4↓+2NO↑+4H+,
故答案為:排盡裝置中的空氣,在隔絕空氣條件下分解;將NH3、H20(g)全部趕入到裝置B中;3Ba2++3SO2+2NO3-+2H2O═3BaSO4↓+2NO↑+4H+;
(2)根據過濾操作可知,所用到的玻璃儀器有玻璃棒、燒杯、漏斗,硫酸鋇沉淀在氯化鋇沉淀中析出,可以通過檢驗沉淀表面是否有氯離子或鋇離子判斷沉淀是否洗凈,操作是:取最后一次洗滌液濾液適量于試管中,加入硫酸鈉溶液(或硝酸酸化的硝酸銀溶液),若無沉淀生成,則沉淀洗凈,
故答案為:燒杯、漏斗;取最后一次洗滌液濾液適量于試管中,加入硫酸鈉溶液(或硝酸酸化的硝酸銀溶液),若無沉淀生成,則沉淀洗凈;
(3)滴定過程中亞鐵離子被高錳酸鉀氧化成鐵離子,反應的離子方程式為MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,判斷滴定終點的現象是滴加最后一滴KMn04溶液時,溶液恰好呈紫紅色,且半分鐘內不再變化,
故答案為:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;滴加最后一滴KMn04溶液時,溶液恰好呈紫紅色,且半分鐘內不再變化;
(4)根據實驗原理可知,稱取ag晶體完全溶于水,加入過量BaCI2溶液,過濾、洗滌、干燥沉淀,稱得沉淀質量為46.6g,根據硫酸根離子守恒,硫酸根離子的物質的量和硫酸鋇的物質的量是相等的,即為:$\frac{46.6g}{233g/mol}$=0.2mol,稱取a g晶體溶于水,配成250mL溶液,取25.00mL溶液于錐形瓶中,用0.1000mol/L的KMn04酸性溶液滴定至終點,消耗KMn04溶液20.00mL,根據離子反應方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,可知樣品中鐵離子的物質的量為:5×0.1000mol/L×0.02L×10=0.1mol,根據電荷守恒可知銨根離子的物質的是為0.2mol×2-0.1mol×2=0.2mol,所以分解產生的氨氣的物質的量也是0.2mol,根據B裝置的質量變化可知反應生成氨氣和水的質量,B裝置在反應后增重14.2g,所以水的質量為14.2g-0.2×17g=10.8g,其物質的量為0.6mol,所以x:y:z=0.1:0.1:0.6=1:1:6,化學式為:FeSO4•(NH4)2SO4•6H2O,
故答案為:FeSO4•(NH4)2SO4•6H2O.
點評 本題涉及中和滴定、實驗基本操作以及守恒法來確定物質的分子式等知識的綜合考查題,要求學生具有分析和解決問題的能力,難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 編號 | 實驗操作 | 目的 |
| A | 取4gNaOH固體溶于100mL水中 | 配制0.1mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1-2mLFeCl3飽和溶液,攪拌并繼續煮沸到變成紅褐色 | 制備Fe(OH)3膠體 |
| C | 測定等物質的量濃度的鹽酸、硝酸的pH | 比較Cl、N的非金屬性 |
| D | 用MgCl2、AlCl3溶液做導電性試驗 | 證明兩者是離子化合物還是共價化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向50 mL 1 mol•L-1明礬溶液中滴入少量0.1 mol•L-1Ba(OH)2溶液Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| B. | 已知還原性Fe2+>Br-,a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4C1- | |
| C. | 向KI與稀硫酸的混合溶液中通入氧氣:4H++O2+6I-═3I2+2H2O | |
| D. | 在澄清石灰水中加入適量碳酸氫鎂溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質用途 | 解釋 | |
| A | 食醋浸泡水壺中的水垢 | 水垢中CaCO3溶于醋酸,酸性H2CO3>CH3COOH |
| B | 炒菜時加一點酒和醋 | 有酯類物質生成,使菜味香可口 |
| C | NaClO溶液可用作洗手液 | NaClO具有殺菌、消毒作用 |
| D | Al2O3可用作醫藥中的胃酸中和劑 | Al2O3能與胃酸反應,使胃液酸度降低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
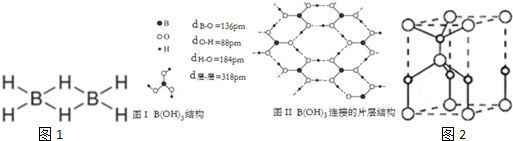
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鐵及其化合物在生活、生產中有廣泛應用.請回答下列問題:
鐵及其化合物在生活、生產中有廣泛應用.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com