
| ||
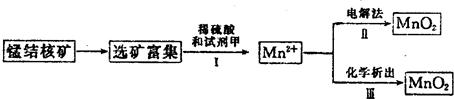
| 11.2L |
| 22.4L/mol |
| 11.2L |
| 22.4L/mol |


科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源:2013屆湖北省部分重點中學(天門中學等)高三上學期期中聯考化學試卷(帶解析) 題型:填空題
(6分) 氯氣在生產生活中應用廣泛。
(1)工業上可用MnSO4溶液吸收氯氣,獲得Mn2O3,Mn2O3廣泛應用于電子工業、印染工業等領域。請寫出該化學反應的化學方程式 。
(2)海底蘊藏著豐富的錳結核礦,其主要成分是MnO2 。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制備純凈的MnO2,其制備過程如下圖所示:
①步驟I中,試劑甲必須具有的性質是 (填序號)。
a. 氧化性 b.還原性 c.酸性
②步驟Ⅲ中,以NaClO3為氧化劑,當生成0.050 mol MnO2時,消耗0.10 mol·L-1的NaClO3溶液200 mL ,該反應的離子方程式為________________。
查看答案和解析>>
科目:高中化學 來源:2014屆河南省洛陽市高三上學期期中考試化學試卷B(解析版) 題型:填空題
氯氣在生產生活中應用廣泛。實驗室可用MnO2與濃鹽酸反應制取,反應原理如下:MnO2+4HCl(濃)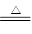 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得標準狀況下11.2 L Cl2,則被氧化的HCl為___________mol。
(2)多余的氯氣可用NaOH溶液吸收,反應的離子方程式為__________。
(3)海底蘊藏著豐富的錳結核礦,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制備純凈的MnO2,其制備過程如下圖所示:
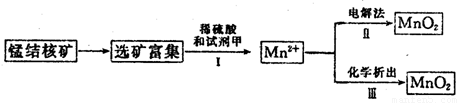
①步驟Ⅰ中, 試劑甲必須具有的性質是____________(填序號)。
A.氧化性B.還原性C.酸性
②步驟Ⅲ中,以NaClO3為氧化劑,當生成0.050 mol MnO2時,消耗0.10 mol·L-1的NaClO3溶液200 mL,該反應的離子方程式為___________________________。
(4)用100mL12.0 mol·L-1的濃鹽酸與足量MnO2混合后,加熱,反應產生的氯氣物質的量遠遠少于0.30 mol,請你分析可能的原因為___________________________。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年湖北省(天門中學等)高三上學期期中聯考化學試卷(解析版) 題型:填空題
(6分) 氯氣在生產生活中應用廣泛。
(1)工業上可用MnSO4溶液吸收氯氣,獲得Mn2O3,Mn2O3廣泛應用于電子工業、印染工業等領域。請寫出該化學反應的化學方程式 。
(2)海底蘊藏著豐富的錳結核礦,其主要成分是MnO2 。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制備純凈的MnO2,其制備過程如下圖所示:
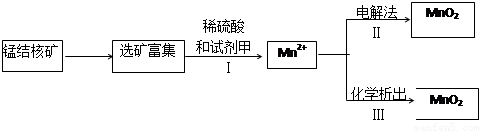
①步驟I中,試劑甲必須具有的性質是 (填序號)。
a. 氧化性 b.還原性 c.酸性
②步驟Ⅲ中,以NaClO3為氧化劑,當生成0.050 mol MnO2時,消耗0.10 mol·L-1 的NaClO3溶液200 mL ,該反應的離子方程式為________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com