
 ①FeSO4還原Cr2O72-的離子方程式為______.
①FeSO4還原Cr2O72-的離子方程式為______.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:閱讀理解
 鉻(Cr)屬于重金屬元素,含鉻廢水和廢渣排放必須經過處理達到有關的安全標準.
鉻(Cr)屬于重金屬元素,含鉻廢水和廢渣排放必須經過處理達到有關的安全標準.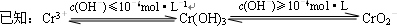 ①FeSO4還原Cr2O72-的離子方程式為
①FeSO4還原Cr2O72-的離子方程式為查看答案和解析>>
科目:高中化學 來源: 題型:
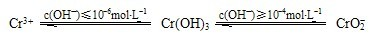
查看答案和解析>>
科目:高中化學 來源: 題型:
鉻(Cr)屬于重金屬元素,含鉻廢水和廢渣排放必須經過處理達到有關的安全標準。
(1)含鉻廢水排放到河水中一定濃度會使魚類等水生動物死亡的原因是 ;
(2)鉻元素以Cr2O72-的形式存在于酸性廢水中,常用FeSO4將其還原為Cr3+,再用沉淀法進行分離。
|
|
① FeSO4還原Cr2O72-的離子方程式為 。
② Cr2 (SO4) 3溶液中加入過量NaOH濃溶液,反應的離子方程式為 。
③ 沉淀法分離廢水中的Cr3+離子,pH應控制在 范圍內。
④ 下列關于鉻及其化合物的說法中正確的是 。
a.K2Cr2O7是一種常用的強氧化劑
b.NaCrO2溶液與AlCl3溶液混合有沉淀生成
c.酸性K2Cr2O7溶液可用于檢驗司機是否酒后駕車
d.金屬鉻硬度大、耐腐蝕,是常用的鍍層金屬
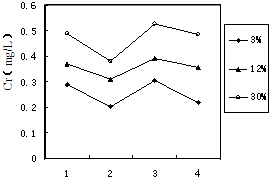
(3)鉻冶煉工業的廢渣粉碎后摻入煤矸石經過高溫處理可以制磚,為了探究其中的鉻元素在使用過程中是否會重新污染環境,研究組在一定條件下浸溶磚樣,檢測浸出液中Cr元素濃度,結果如圖:


我國規定“固體廢棄物浸出標準值含鉻不得超過10 mg·L-1”。分析圖表,可得出多個結論:
① 實驗取用的磚樣是否符合上述標準: 。
② 還能得出的其它結論是(寫出2條即可): ; 。
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com