
(16分)尿素(H2NCONH2)是一種非常重要的高氮化肥,工業上合成尿素的反應分為如下兩步:
第1步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸銨) (l) △H1= —330.0 kJ·mol-1
H2NCOONH4(氨基甲酸銨) (l) △H1= —330.0 kJ·mol-1
第2步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)
△H2=+226.3 kJ·mol-1
H2O(l)+H2NCONH2(l)
△H2=+226.3 kJ·mol-1
(1)寫出工業合成尿素的熱化學方程式:
(2)下列措施中有利于提高尿素的產率的是___________。
A.采用高溫 B.采用高壓 C.添加高效催化劑 D.定時分離尿素
(3)某實驗小組模擬工業上合成尿素的條件,在一體積為0.5 L密閉容器中投入4 mol氨和1mol二氧化碳,實驗測得反應中各組分隨時間的變化如下圖所示:
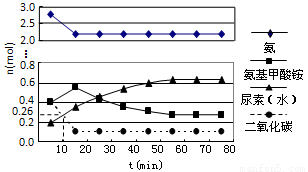
①已知總反應的快慢由慢的一步決定,則合成尿素總反應的快慢由第 步反應決定。
②反應進行到10 min時測得CO2的物質的量如上圖所示,則用CO2表示的第一步反應的速率v(CO2)= 。
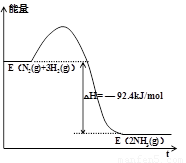
(4)工業上合成氨常與尿素生產聯合進行以提高經濟效益,合成氨的熱化學方程式如下:
N2(g) + 3H2(g)  2NH3(g)
△H = —92.4 kJ/mol
2NH3(g)
△H = —92.4 kJ/mol
請在答題卡的坐標圖中,畫出反應過程中體系的能量變化圖(進行必要的標注)。
(5)有一工業投產前小實驗:在一定溫度和壓強下,將6 molH2和2 molN2在2L密閉容器中混合,當該反應達到平衡時,測得平衡混合氣中NH3的體積分數約為11.1%(即1/9),此時H2的轉化率是多少?(寫出計算過程,計算結果保留3位有效數字。)
(1)2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1 (2分)
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1 (2分)
(2)BD (2分,錯選不給分)
(3)①2 (2分) ②0.148 mol/(L·min) (2分)
(4)(3分)
(5)(5分)
解: 設平衡時N2轉化了的濃度為x
N2 + 3H2  2NH3
2NH3
C(開始) mol/L 1 3 0
C(轉化) mol/L x 3x 2x
C(平衡) mol/L 1-x 3-3x 2x
2x/(1-x+3-3x+2x)×100%=11.1% (3分)
x=0.200 mol/L(1分)
H2的轉化率=3×0.200 mol/L /3 mol/L ×100%=20.0% (1分)
【解析】


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com