
【題目】將兩份過量的鋅粉 a、b 分別加入定量的稀硫酸,同時向 a 中加入少量的 CuSO4 溶液,產生H2 的體積 V(L)與時間 t(min)的關系正確的是( )。
A.
B.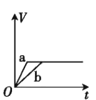
C.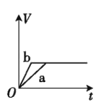
D.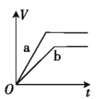
【答案】B
【解析】
兩份鋅粉a、b,分別加入稀H2SO4中,鋅會置換出硫酸中的氫,生成氫氣;同時向a中放入少量的CuSO4溶液,則會發生:Zn+Cu2+=Zn2++Cu,會形成原電池,反應速率增大,則a的曲線斜率大于b的斜率;由于鋅過量,所以生成的氫氣的體積與稀硫酸的物質的量成正比,由信息可知,生成的氫氣的體積應該相等,由此結合選項判斷。
過量的兩份鋅粉a、b,分別加入稀H2SO4中,同時向a中放入少量的CuSO4溶液,則a中還發生的反應為:Zn+Cu2+=Zn2++Cu,銅-鋅-稀硫酸形成原電池,反應速率增大,反應用時少于b,由于鋅過量,所以生成的氫氣的體積由硫酸的物質的量決定,稀硫酸的量相同,所以最終兩者產生的氫氣體積相等,答案選B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.由單質A轉化為單質B是一個吸熱過程,由此可知單質B比單質A穩定
B.500℃、30M Pa下,將0.5 mol N2和1.5 mol H2置于密閉容器中充分反應生成NH3(g),放熱19.3 kJ,其熱化學方程式為:N2(g)+3H2(g) ![]() 2NH3(g) ΔH = -38.6 kJ/mol
2NH3(g) ΔH = -38.6 kJ/mol
C.已知熱化學方程式:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH = -Q kJ/mol ,若將一定量的SO2(g)和O2(g)置于密閉容器中充分反應后放出熱量Q kJ,則此過程中有2 mol SO2(g)被氧化
2SO3(g) ΔH = -Q kJ/mol ,若將一定量的SO2(g)和O2(g)置于密閉容器中充分反應后放出熱量Q kJ,則此過程中有2 mol SO2(g)被氧化
D.X(g)+Y(g)![]() Z(g) ΔH >0,恒溫恒容條件下達到平衡后加入X,上述反應ΔH增大
Z(g) ΔH >0,恒溫恒容條件下達到平衡后加入X,上述反應ΔH增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦鐵礦是鐵和鈦的氧化物礦物,成分可表示為FeTiO3(Ti為+4價)。鈦白粉(TiO2)涂料、塑料、油墨、造紙行業具有廣泛的用途,制備流程如圖:
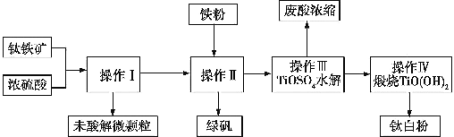
(1)鈦鐵礦與硫酸反應時可表示為FeTiO3+H2SO4→TiOSO4+X+H2O,其中X的化學式為 ______,該反應為______ (填“氧化還原反應”或“非氧化還原反應”)。
(2)某鈦鐵礦中FeTiO3的含量為76%,該鈦鐵礦與硫酸反應時Ti轉化率為92%,操作I到操作IV的過程中Ti的轉化率為96%,則1t該鈦鐵礦可生產鈦白粉 ______ t(所有計算結果保留兩位有效數字),能否計算綠礬的產量______?(若能則計算數值,否則說明理由)。
(3)操作I的名稱是 ______,操作II包括攪拌、結晶、______,操作II中加入鐵粉的目的是______(用離子方程式表示)。
(4)寫出操作III中TiOSO4水解的化學方程式: ______ 。
(5)該生產過程中產生的尾氣SO2、SO3的處理方法是 ______ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數值,下列說法正確的是( )
A.46gNO2和N2O4混合氣體中含有原子數為3.5NA
B.50g質量分數為46%的乙醇水溶液中氧原子數為2NA
C.用惰性電極電解H2SO4溶液,若陽極產生5.6L氣體,則電路中通過0.5NA電子
D.常溫下,1LpH=3的醋酸溶液稀釋到10L時,溶液中H+的數目大于0.01NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、W的原子序數依次增大。四種元素形成的單質依次為m、n、p、q; r、t、u是這些元素組成的二元化合物,其中u為葡萄酒中抑菌成分;25℃時,0.01mol/L的v溶液中: =1.0×10-10。上述物質的轉化關系如圖所示。下列說法正確的是( )
=1.0×10-10。上述物質的轉化關系如圖所示。下列說法正確的是( )
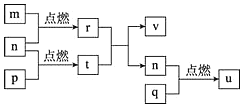
A.原子半徑的大小:X<Y<Z<W
B.元素的非金屬性:Y>W>X
C.t中只含離子鍵
D.v能抑制水的電離而u能促進水的電離
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源開發、環境保護、資源利用等是當今社會的熱門話題。請根據所學化學知識回答下列問題:
(1)汽車上安裝催化轉化器,可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應,生成無毒物質,減少汽車尾氣污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ·mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1;
則尾氣轉化反應2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)某硝酸廠利用甲醇處理廢水。在一定條件下,向廢水中加入CH3OH,將HNO3還原成N2。若該反應消耗32 g CH3OH轉移6 mol電子,則參加反應的還原劑和氧化劑的物質的量之比為______________。
(3)煤的間接液化是先轉化為CO和H2,再在催化劑作用下合成甲醇。若在一定溫度下,向1 L密閉容器中加入CO和H2,發生反應CO(g)+2H2(g)CH3OH(g),經10 min反應達到平衡時測得各組分的濃度如下:
物質 | CO | H2 | CH3OH |
濃度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①該反應的平衡常數表達式為:K=_____________________。
②該時間內反應速率υ(H2)=_________________。
③平衡時CO的轉化率為_________________(保留1位小數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有a、b、c、d四個金屬電極,有關的反應裝置及部分反應現象如下:
實驗裝置 | 部分實驗現象 |
| a極質量減小,b極質量增加 |
| b極有氣體產生,c極無變化 |
| d極溶解,c極有氣體產生 |
| 電流計指示在導線中電流從a極流向d極 |
由此可判斷這四種金屬的活動性順序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用甲苯生產鄰羥基苯甲酸甲酯: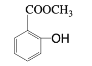 ,下列反應① ~⑥ 是其合成過程,其中某些反應條件及部分反應物或生成物未注明。
,下列反應① ~⑥ 是其合成過程,其中某些反應條件及部分反應物或生成物未注明。
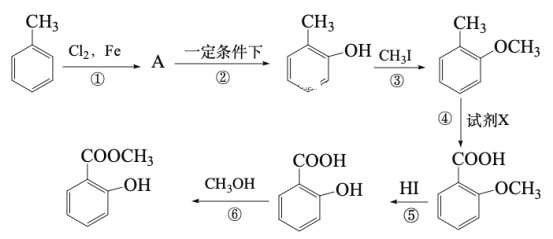
回答下列問題:
(1)有機物A的結構簡式為___________________,習慣命名法A的名稱為______________。
(2)反應②的化學方程式是________________________________________。
(3)試劑X是___________________。
(4)反應⑥ 的化學方程式是___________________________________。
(5)合成路線中設計③ 、⑤ 兩步反應的目的是_____________________________。
(6)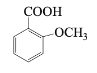 的同分異構體中,既能與NaHCO3發生反應,又能與FeCl3溶液發生顯色反應的共有_________種,其中核磁共振氫譜為5組峰,且峰面積比為2:2:2:1:1的有機物結構簡式為________________。
的同分異構體中,既能與NaHCO3發生反應,又能與FeCl3溶液發生顯色反應的共有_________種,其中核磁共振氫譜為5組峰,且峰面積比為2:2:2:1:1的有機物結構簡式為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物M具有廣譜抗菌活性,合成M的反應可表示如下:
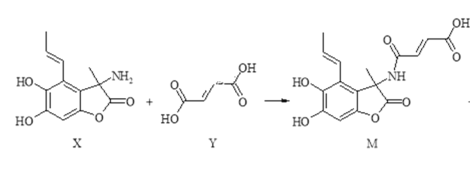 +H2O
+H2O
下列說法正確的是( )
A.X分子中有5種官能團
B.Y分子中所有原子不可能在同一平面內
C.可用FeCl3溶液或NaHCO3溶液鑒別X和M
D.在NaOH溶液中,1molX最多可與4molNaOH發生反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com