
【題目】已知X、Y、Z、W為短周期主族元素,在周期表中的相對位置如圖,下列說法正確的是( )

A. 若HmXOn為強酸,則X的氫化物溶于水一定顯酸性(m、n均為正整數)
B. 若四種元素均為金屬,則Z的最高價氧化物對應的水化物一定為強堿
C. 若四種元素均為非金屬,則W的最高價氧化物對應的水化物一定為強酸
D. 若四種元素中只有一種為金屬,則Z與Y兩者的最高價氧化物對應的水化物能反應
科目:高中化學 來源: 題型:
【題目】Ⅰ. (1)已知下列熱化學方程式:①2Zn(s)+O2(g)= 2ZnO(s) ΔH1=-702.2 kJ·mol-1②2Hg(l)+O2(g)= 2HgO(s) ΔH2=-181.4 kJ·mol-1,由此可知Zn(s)+HgO(s)= ZnO(s)+Hg(l) ΔH3,其中ΔH3為___kJ·mol-1。
(2)乙醇是未來內燃機的首選環保型液體燃料,它可以由綠色植物的秸稈制取,1.0 g乙醇完全燃燒生成液態水放出1.367 kJ熱量,表示乙醇燃燒熱的熱化學方程式為__________。
Ⅱ. 一定條件下,將SO2和O2充入一密閉容器中,發生如下反應:2SO2(g)+O2(g)![]() 2SO3(g)(正反應放熱)反應過程中SO2、O2、SO3物質的量變化如圖所示,回答下列問題:
2SO3(g)(正反應放熱)反應過程中SO2、O2、SO3物質的量變化如圖所示,回答下列問題:
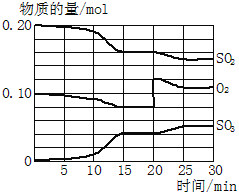
(3)降低溫度,SO2的轉化率______,化學反應速率____。(填“增大”“減小”或“不變”)
(4)反應處于平衡狀態的時間是_____、_______。
(5)反應進行至20 min時,曲線發生變化的原因是____(用文字表達)。10 min到15 min的曲線變化的原因可能是____(填寫編號)。
a. 加了催化劑 b. 縮小容器體積 c. 降低溫度 d. 增加SO3的物質的量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對下列有機反應類型的認識中,不正確的是( )
A.![]() +HNO3
+HNO3![]()
![]() +H2O;取代反應
+H2O;取代反應
B.CH4+Cl2 ![]() CH3Cl + HCl ;置換反應
CH3Cl + HCl ;置換反應
C.CH2=CH2+H2O![]() CH3—CH2OH;加成反應
CH3—CH2OH;加成反應
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;酯化反應
CH3COOC2H5+H2O;酯化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各表述與示意圖不一致的是
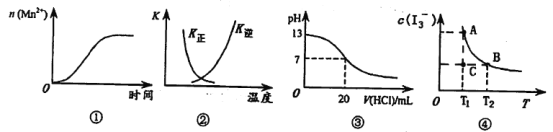
A.圖①表示5 mL 0.01 mol·L-1 KMnO4酸性溶液與過量的0.1 mol·L-1 H2C2O4溶液混合時,n(Mn2+)隨時間的變化
B.圖②中曲線表示反應2SO2(g)+O2(g)![]() 2SO3(g) △H<0正、逆反應的平衡常數K隨溫度的變化
2SO3(g) △H<0正、逆反應的平衡常數K隨溫度的變化
C.圖③表示25℃時,用0.1 mol·L-1鹽酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH隨加入酸體積的變化
D.I2在KI溶液中存在I2(aq)+I-(aq)![]() I3-(aq)的平衡,c(I3-)與溫度T的關系如圖④,若反應進行到狀態C時,一定有V(正)>V(逆)
I3-(aq)的平衡,c(I3-)與溫度T的關系如圖④,若反應進行到狀態C時,一定有V(正)>V(逆)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】pH=2的兩種一元酸x和y,體積均為100 mL,稀釋過程中pH與溶液體積的關系如下圖所示。分別滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的體積為Vx、Vy則( )
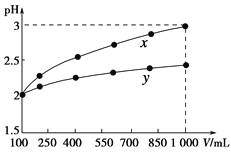
A.x為弱酸,Vx<VyB.x為強酸,Vx>Vy
C.y為弱酸,Vx<VyD.y為強酸,Vx>Vy
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示:

下列說法正確的是
A.甲池通入O2的電極反應為O2 + 4e-+ 4H+=2H2O
B.乙池 Ag電極增重6.4g,溶液中將轉移0.2mol電子
C.反應一段時間后,向乙池中加入一定量Cu(OH)2固體,能使CuSO4溶液恢復到原濃度
D.甲池中消耗280 mL(標準狀況下)O2,此時丙池中理論上最多產生1.45g固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】立德粉ZnS·BaSO4(也稱鋅鋇白),是一種常用白色顏料。回答下列問題:
(1)利用焰色反應的原理既可制作五彩繽紛的節日煙花,亦可定性鑒別某些金屬鹽。灼燒立德粉樣品時,鋇的焰色為__________(填標號)。
A.黃色 B.紅色 C.紫色 D.綠色
(2)以重晶石(BaSO4)為原料,可按如下工藝生產立德粉:
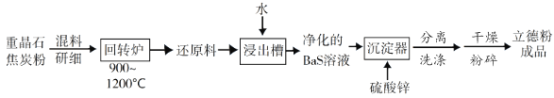
①在回轉爐中重晶石被過量焦炭還原為可溶性硫化鋇,該過程的化學方程式為______________________。回轉爐尾氣中含有有毒氣體,生產上可通過水蒸氣變換反應將其轉化為CO2和一種清潔能源氣體,該反應的化學方程式為______________________。
②在潮濕空氣中長期放置的“還原料”,會逸出臭雞蛋氣味的氣體,且水溶性變差。其原因是“還原料”表面生成了難溶于水的___________(填化學式)。
③沉淀器中反應的離子方程式為______________________。
(3)成品中S2的含量可以用“碘量法”測得。稱取m g樣品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L1的I2KI溶液于其中,并加入乙酸溶液,密閉,置暗處反應5 min,有單質硫析出。以淀粉溶液為指示劑,過量的I2用0.1000 mol·L1Na2S2O3溶液滴定,反應式為I2+2![]() =2I+
=2I+![]() 。測定時消耗Na2S2O3溶液體積V mL。終點顏色變化為_________________,樣品中S2的含量為______________(寫出表達式)。
。測定時消耗Na2S2O3溶液體積V mL。終點顏色變化為_________________,樣品中S2的含量為______________(寫出表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)![]() 碳與適量水蒸氣反應生成CO和H2,需吸收
碳與適量水蒸氣反應生成CO和H2,需吸收![]() 熱量,此反應的熱化學方程式為_________________
熱量,此反應的熱化學方程式為_________________
(2)已知![]() ;
;![]()
![]() ;
;![]()
![]() ;
;![]()
常溫下,取體積比4:1的甲烷和氫氣的混合氣體![]() (標準狀況下),經完全燃燒后恢復至室溫,則放出的熱量為___________
(標準狀況下),經完全燃燒后恢復至室溫,則放出的熱量為___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學利用氧化還原反應:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O設計如下原電池,鹽橋中裝有飽和KCl溶液。下列說法正確的是

A. b電極上發生還原反應
B. 外電路電子的流向是從a到b
C. 電池工作時,鹽橋中的SO42-移向甲燒杯
D. a電極上發生的反應為:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com