
| 反應過程 | 化學方程式 | 焓變△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |


分析 (1)根據蓋斯定律,由蒸汽重整的兩個反應:CH4(g)+2H2O(g)=CO2(g)+4H2(g)減CH4(g)+H2O(g)=CO(g)+3H2(g),可得反應:CO(g)+H2O(g)=CO2(g)+H2(g),據此計算反應熱;
(2)由表中數據可知,甲烷氧化的活化能低于蒸氣重整的活化能,活化能越低,反應速率越快;
(3)由題目信息可知,用某組分(B)的平衡壓強(PB)表示平衡常數為:生成物分壓的系數次冪乘積與反應物分壓系數次冪乘積的比;
該反應為吸熱反應,升高溫度,平衡向正反應移動,平衡常數增大;
(4)從能量的角度分析,放熱的甲烷氧化反應為吸熱的蒸氣重整提供能量;
(5)①根據圖象中溫度、壓強對H2和CO物質的量分數的影響,選擇判斷;
②結合圖象可知在600℃、0.1 MPa的條件下,平衡時系統中H2的物質的量分數達到70%,起始進料時H2的物質的量分數為0,畫出H2的物質的量分數隨時間變化的示意圖;
(6)如果反應過程中進氧氣的量過大,會導致生成的氫氣和氧氣反應,導致質量分數降低.
解答 解:(1)已知:①CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
根據蓋斯定律,①-②可得反應:CO(g)+H2O(g)=CO2(g)+H2(g),故△H=165.0kJ/mol-206.2kJ/mol=-41.2kJ/mol,
故答案為:-41.2;
(2)由表中數據可知,甲烷氧化的活化能低于蒸氣重整的活化能,活化能越低,反應速率越快,故初始階段,甲烷蒸汽重整的反應速率小于甲烷氧化的反應速率,故答案為:小于;
(3)可知反應CH4(g)+H2O(g)?CO(g)+3H2(g)的KP=$\frac{{p}^{3}({H}_{2})×p(CO)}{p(C{H}_{4})×p({H}_{2}O)}$;
該反應為吸熱反應,升高溫度,平衡向正反應移動,平衡常數增大,
故答案為:$\frac{{p}^{3}({H}_{2})×p(CO)}{p(C{H}_{4})×p({H}_{2}O)}$;增大;
(4)從能量的角度分析,甲烷自熱重整方法的先進之處在于:放熱的甲烷氧化反應為吸熱的蒸氣重整提供能量,提高能源的利用率,
故答案為:放熱的甲烷氧化反應為吸熱的蒸氣重整提供能量;
(5)①由圖中數據可知,0.9 MPa時,H2的物質的量分數>65%,CO物質的量分數<10%,則700℃符合,1.5 MPa時,H2的物質的量分數>65%,則溫度要高于750℃,CO物質的量分數<10%,低于750℃,矛盾,故B正確,ACD錯誤,
故選:B;
②起始進料時H2的物質的量分數為0,結合圖象可知600℃,0.1 MPa的條件下,平衡時系統中H2的物質的量分數達到70%,H2的物質的量分數隨時間變化的示意圖為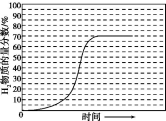 ,故答案為:
,故答案為: ;
;
(6)如果反應過程中進氧氣的量過大,會導致生成的氫氣和氧氣反應,導致質量分數降低,故答案為:導致生成的氫氣和氧氣反應.
點評 本題考查化學平衡圖象、化學反應速率、反應熱計算等,旨在考查考生分析處理數據和解答圖象試題的能力,難度中等.


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 以天然氣為原料合成甲醇常見的方法有水煤氣法和目前正在開發的直接氧化法
以天然氣為原料合成甲醇常見的方法有水煤氣法和目前正在開發的直接氧化法查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10 min后向容器中加入A,再次達平衡時,A的轉化率一定大于50% | |
| B. | 前10 min內反應的平均速率υ(C)=0.1 mol•L-1•min-1 | |
| C. | 恒溫下,將壓強變為原來的2倍,則再次達平衡時D的濃度小于1 mol•L-1 | |
| D. | 反應達平衡時c(B)=1.5 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 實驗步驟和方法 | 實驗現象 |
| 1.把7瓶液體分別依次標號A、B、C、D、E、F、G后聞氣味 | 只有F、G兩種液體沒有氣味 |
| 2.各取少量于試管中加水稀釋 | 只有C、D、E三種液體不溶解而浮在水上層 |
| 3.分別取少量7種液體于試管中加新制的Cu(OH)2懸濁液并加熱 | 只有B使沉淀溶解,F中產生磚紅色沉淀 |
| 4.各取C、D、E少量于試管中,加稀NaOH溶液并加熱 | 只有C仍有分層現象,且E中發生了皂化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2+H2O═H2CO3 化合反應 | |
| B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O 分解反應 | |
| C. | Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$ 2Fe+3CO2 置換反應 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3 復分解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 軟錳礦(主要成分MnO2,雜質金屬元素Fe、Al、Mg等)的水懸濁液與煙氣中SO2反應可制備MnSO4•H2O,反應的化學方程式為:MnO2+SO2═MnSO4.
軟錳礦(主要成分MnO2,雜質金屬元素Fe、Al、Mg等)的水懸濁液與煙氣中SO2反應可制備MnSO4•H2O,反應的化學方程式為:MnO2+SO2═MnSO4.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{4}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{2}$ | D. | $\frac{2}{3}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com