
| 元素編號 | 元素性質與原子(或分子)結構 |
| T | 最外層電子數是次外層電子數的 3 倍 |
| X | 常溫下單質為雙原子分子,分子中含有 3 對共用電子對 |
| Y | M 層比 K 層少 1 個電子 |
| Z | 第 3 周期元素的簡單離子中半徑最小 |
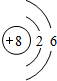
分析 短周期元素中,T原子元素最外層電子數是次外層電子數的 3 倍,由于最外層電子數不超過8,則T原子有2個電子層,最外層電子數為6,則T為O元素;常溫下X元素單質為雙原子分子,分子中含有 3 對共用電子對,則X為N元素;Y元素原子的M 層比 K 層少 1 個電子,則Y為Na;第3周期元素的簡單離子中Z的離子半徑最小,則Z為Al元素.
解答 解:短周期元素中,T原子元素最外層電子數是次外層電子數的 3 倍,由于最外層電子數不超過8,則T原子有2個電子層,最外層電子數為6,則T為O元素;常溫下X元素單質為雙原子分子,分子中含有 3 對共用電子對,則X為N元素;Y元素原子的M 層比 K 層少 1 個電子,則Y為Na;第3周期元素的簡單離子中Z的離子半徑最小,則Z為Al元素.
(1)T為O元素,原子結構示意圖為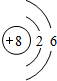 ,故答案為:
,故答案為: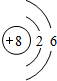 ;
;
(2)同周期自左而右金屬性減弱,故Na的金屬性比Al的強,
A.單質的熔點屬于物理性質,不能比較金屬性強弱,故A錯誤;
B.金屬性強弱與失去電子難易程度有關,與失去電子數目無關,即與元素化合價無關,故B錯誤;
C.Na單質與水反應比 Al單質劇烈,說明Na的金屬性更強,故C正確;
D.金屬性越強,最高價氧化物對應水化物的堿性越強,Na最高價氧化物的水化物的堿性比 Al的強,說明鈉的金屬性更強,故D正確,
故答案為:Na;CD;
(3)氮元素的氣態氫化物與其最高價含氧酸反應的離子方程式為:NH3+H+=NH4+,
故答案為:NH3+H+=NH4+;
(4)元素 T(氧) 和氫元素以原子個數比 1:1 化合形成化合物 Q為H2O2,元素 X(氮) 與氫元素以原子個數比 1:2 化合形成常用作火箭燃料的化合物 W為N2H4,二者 發生氧化還原反應,生成氮氣和水,該反應的化學方程式為:2H2O2+N2H4=4H2O+N2↑,
故答案為:2H2O2+N2H4=4H2O+N2↑.
點評 本題考查位置結構與性質的關系,試題側重于學生的分析能力的考查,正確推斷各元素為解答關鍵,注意掌握金屬性、非金屬性強弱比較實驗事實.


 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na+的電子排布圖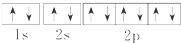 | B. | Na+的結構示意圖: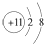 | ||
| C. | Na的電子排布式:1s22s22p63s1 | D. | Na的簡化的電子排布式:[Na]3s1 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
| 元素編號 | 元素性質或原子結構 |
| T | M層上有6個電子 |
| W | 短周期內原子半徑最大的元素 |
| N | 原子序數比T小,且與T在同一主族 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 常溫下單質為雙原子分子,其氨化物的水溶液呈堿性 |
| Z | 元素最高正價為+7價 |
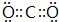 ,Y的簡單氫化物的結構式
,Y的簡單氫化物的結構式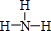 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
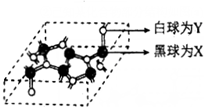 |  |
| 圖(a) | 圖(b) |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液中的溶質只有NH4Cl | |
| B. | 當溶液呈堿性時:c(NH4+)+c(H+)<c(Cl-)+c(OH-) | |
| C. | 溶液中離子濃度大小關系可能為:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 該溶液可能由pH=12的氨水與pH=2的HCl溶液等體積混合而成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol-NH2中含有的電子數為0.7NA | |
| B. | 標準狀況下,2.24 L乙醇中含有的C-H數目為0.5NA | |
| C. | 常溫常壓下,65 g Zn與足量濃H2SO4充分反應,轉移電子數一定為2NA | |
| D. | 2.24 L NO與1.12 L O2充分反應所得氣體中原子數目一定為0.3NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com