
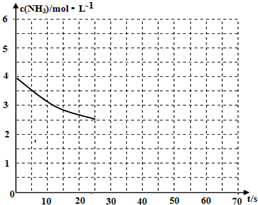
 一定條件下,反應2NH3(g)?N2(g)+3H2(g)達到平衡時N2的體積分數與溫度、壓強的關系如圖所示.下列說法正確的是( )
一定條件下,反應2NH3(g)?N2(g)+3H2(g)達到平衡時N2的體積分數與溫度、壓強的關系如圖所示.下列說法正確的是( )| A. | 壓強:p1>p2 | B. | b、c兩點對應的平衡常數:Kc>Kb | ||
| C. | a點:2v(NH3)正═3v(H2)逆 | D. | a點:NH3的轉化率為$\frac{1}{3}$ |
分析 一定條件下,反應2NH3(g)?N2(g)+3H2(g),反應前后氣體體積增大,圖象分析可知溫度升高N2的體積分數增大,說明反應正向為吸熱反應,壓強越大平衡逆向進行氮氣體積分數減小,P1<P2,平衡常數隨溫度變化.
解答 解:一定條件下,反應2NH3(g)?N2(g)+3H2(g),反應前后氣體體積增大,圖象分析可知溫度升高N2的體積分數增大,說明反應正向為吸熱反應,壓強越大平衡逆向進行氮氣體積分數減小,P1<P2,平衡常數隨溫度變化.,
A.圖象分析可知壓強p1<p2 ,故A錯誤;
B.bc點是不同溫度下的狀態,溫度越高平衡正向進行,平衡常數增大,則Kc>Kb ,故B正確;
C.a點是一定條件下的平衡狀態,速率之比等于化學方程式計量數之比為正反應速率之比,3v(NH3)正═2v(H2)逆 能說明氫氣正逆反應速率相同,故C錯誤;
D.設氨氣起始量為2mol,折平衡后生成氮氣物質的量為x,
2NH3(g)?N2(g)+3H2(g),
起始量(mol) 2 0 0
變化量(mol) 2x x 3x
平衡量(mol) 2-2x x 3x
圖象可知氮氣體積分數為0.1,則$\frac{x}{2+2x}$=0.1,
x=0.25mol,氨氣轉化率=$\frac{2×0.25}{2}$×100%=25%,故D錯誤;
故選B.
點評 本題考查了圖象分析、影響反應速率、平衡的因素分析判斷、化學平衡三行計算的應用,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | $\frac{z}{12m}$ | B. | $\frac{12z}{m}$ | C. | $\frac{{N}_{A}}{m}$ | D. | $\frac{{N}_{A}}{z}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (2)①用氨氣制取尿素[CO(NH2)]的反應為:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨氣制取尿素[CO(NH2)]的反應為:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
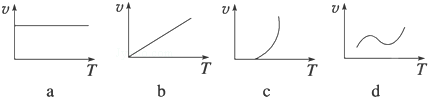
| 溫度/℃ | 1000 | 1100 |
| 平衡常數 | 0.68 | 0.50 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A | B | C | D | |
| 研究目的 | 壓強對反應的影響(P2>P1) | 溫度對反應的影響 | 平衡體系增加N2對反應的影響 | 催化劑對反應的影響 |
| 圖示 | 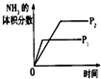 | 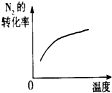 | 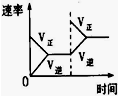 | 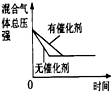 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 肼(N2H4)廣泛用于火箭推進劑、有機合成及電池燃料.請回答下列問題:
肼(N2H4)廣泛用于火箭推進劑、有機合成及電池燃料.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Ba2+、SO42-,Fe3+、K+ | B. | OH-、C1-、Na+ | ||
| C. | NH4+、NO3-、A13+、K+ | D. | HCO3-、SO42-、Na+、H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg2+、Na+、SO42-、Cl- | B. | K+、CO32-、Cl-、NO3- | ||
| C. | Na+、K+、NO3-、SO42- | D. | NH4+、Na+、SO42-、NO3- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com