分析:A、二氧化碳中碳原子與氧原子之間形成2對共用電子對,滿足8電子穩定.
B、共用電子對用短線“-”代替,為結構式,省略C-H鍵即為結構簡式.
C、比例模型主要表現原子相對大小,空間結構,大致體現原子的連接順序,不能體現成鍵類型.
D、氯原子得1個電子形成氯離子,質子數不變.
解答:解:A、碳原子最外層有4個電子,要達到穩定結構要形成四對共用電子對,電子式為
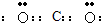
而,題中給出的電子式中碳原子只有兩對共用電子對,故A錯誤;
B、

乙烷的結構簡式,乙烷結構式為

,故B錯誤;
C、由圖可知大球為碳原子,小球為氫原子,符合碳原子比氫原子大,并且也符合甲烷空間結構,故C正確;
D、氯原子得1個電子形成氯離子,質子數不變為17,核外電子數為18,故D錯誤.
故選:C.
點評:考查常用化學用語,難度較小,注意常用化學用語的書寫,注意B中結構式與結構簡式容易忽略混用.

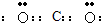 而,題中給出的電子式中碳原子只有兩對共用電子對,故A錯誤;
而,題中給出的電子式中碳原子只有兩對共用電子對,故A錯誤; 乙烷的結構簡式,乙烷結構式為
乙烷的結構簡式,乙烷結構式為 ,故B錯誤;
,故B錯誤;
