
【題目】高鐵酸鹽在能源環保領域有廣泛用途。用鎳(Ni)、鐵作電極電解濃NaOH將收制備高鐵酸鹽Na2FeO4的裝置如圖所示。下列推斷合理的是

A. 鎳是陽極,電極反應為4OH--4e-=O2↑+2H2O
B. 電解時電流的方向為:負極→Ni電極→溶液→Fe→電極→正極
C. 若隔膜為陰離子交換膜,則OH-自右向左移動
D. 電解時陽極區pH降低、陰極區pH升高(假設電解前后體積變化忽略不計)
 同步學典一課多練系列答案
同步學典一課多練系列答案 經典密卷系列答案
經典密卷系列答案 金牌課堂練系列答案
金牌課堂練系列答案 三新快車金牌周周練系列答案
三新快車金牌周周練系列答案科目:高中化學 來源: 題型:
【題目】根據如圖提供的信息,下列所得結論正確的是( ) 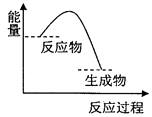
A.該反應過程中,形成新化學鍵釋放的總能量小于斷裂舊化學鍵吸收的總能量
B.因為生成物的總能量低于反應物的總能量,所以該反應不需要加熱即可進行
C.該圖象可以表示碳酸鈣受熱分解的能量變化
D.該圖象可以表示鋅與稀硫酸反應的能量變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T℃,將2 mol X和1 mol Y充入體積為1L的密閉容器中,已知:2X(g)+Y(g) ![]() 2Z(s)△H=-M kJ·mol-1。10 min后達到平衡,生成0.2 mol Z,共放出熱量N kJ,下列說法正確的是 ( )
2Z(s)△H=-M kJ·mol-1。10 min后達到平衡,生成0.2 mol Z,共放出熱量N kJ,下列說法正確的是 ( )
A. 在10 min時,X的反應速率為0.02 mol·L-1·min-l
B. 在0~10 min內,Y的反應速率為![]() mol·L-1·min-l
mol·L-1·min-l
C. 無法計算該溫度下Y的平衡轉化率
D. 反應達平衡后,保持T℃,通入稀有氣體增加壓強,則化學反應速率變快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于氨的合成工業的下列說法正確的是( )
A.從合成塔出來的氣體,其中氨氣一般占15%,所以生產氨的工業的效率都很低
B.由于NH3易液化,N2、H2可循環使用,則總的說來氨的產率很高
C.合成氨工業的反應溫度控制在400~500 ℃左右,目的是使平衡向正反應方向進行
D.合成氨工業采用10 MPa~30 MPa,是因該條件下催化劑的活性最好
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:有機化合物A~F的相互轉化關系如圖,D為石油裂解的主要產物之一,D在標準狀況下的密度為1.25 g·L-1,C能發生銀鏡反應,F為有香味的油狀液體。

請回答:
(1)有機物B中含有的官能團名稱是________________
(2)D→B的反應類型是______________________
(3)B+E→F的化學方程式是__________________________________________
(4)下列有關說法正確的是______________。
a.在加熱條件下,有機物A和C都能使新制的堿性氫氧化銅懸濁液產生磚紅色沉定。
b.F在堿性條件下加熱水解屬于取代反應,又叫皂化反應。
c.D和氧氣在一定條件下反應也可以制得C或E。
d.有機物B中是否混有E可用金屬鈉進行檢測。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關平衡常數K的說法正確的是
A. 已知碳酸: K1=4.4×10-7,K2=4.7×10-11,次氯酸: K1=2.98×10-8,碳酸鈉溶液中滴加少量氯水的離子方程式為: CO32-+Cl2+H2O=HCO3-+Cl-+HClO
B. 1.0mol/LNH4HCO3溶液pH=8.0。由此可知Ka1(H2CO3)> Kb(NH3·H2O)>Ka2(H2CO3)
C. 常溫下電離常數為Ka 的酸HA溶液中c(H+)= ![]()
D. 將0.1mol/LMgSO4溶液滴入NaOH 溶液中至不再有沉淀產生,再滴加0.1mo/LCuSO4溶液,白色沉淀變為藍色沉淀,可得出Ksp[Cu(OH)2]sp[Mg(OH)2]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某密閉容器中的反應:3H2(g)+N2(g)![]() 2NH3(g)△H<0,其正反應速率隨時間變化的情況如圖所示,判斷下列有關t1時刻條件變化的說法可能正確的是
2NH3(g)△H<0,其正反應速率隨時間變化的情況如圖所示,判斷下列有關t1時刻條件變化的說法可能正確的是

A. 增大NH3濃度的同時減小N2濃度 B. 增大N2和H2的濃度
C. 擴大容器的體積 D. 降低反應溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了進一步提高合成氨的生產效率,科研中具有開發價值的是( )
A.研制高溫下活性較大的催化劑
B.尋求NH3的新來源
C.研制低溫下活性較大的催化劑
D.研制耐高溫高壓的新型材料建造合成塔
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在反應KClO3+6HCl=KCl+3Cl2↑+3H2O中,被氧化和被還原的原子的物質的量之比是
A. 1:6 B. 5:1 C. 6:1 D. 3:1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com