
【題目】高鐵電池是一種新型可充電電池該電池能較長時間保持穩定的放電電壓。高鐵電池的總反應為3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
(1)高鐵電池的負極材料是___。
(2)放電時,正極發生__(填“氧化”或“還原”)反應;負極的電極反應式為__。
(3)放電時,__(填“正”或“負”)極附近溶液的堿性增強。
【答案】Zn 還原 Zn-2e-+2OH-=Zn(OH)2 正
【解析】
放電時該裝置相當于原電池,根據原電池有關原理進行解答。
(1)電池的負極上發生氧化反應,正極上發生還原反應。由高鐵電池放電時的總反應方程式可知,負極材料應為Zn。
答案為:Zn。
(2)原電池放電時,正極得到電子發生還原反應,負極材料為鋅,失電子發生氧化反應,由總反應可知溶液為堿性,所以負極反應式為:Zn-2e-+2OH-=Zn(OH)2。
答案為:還原;Zn-2e-+2OH-=Zn(OH)2。
(3)放電時K2FeO4中的Fe的化合價由+6價變為+3價,發生還原反應,電極反應式為:FeO42-+4H2O+3e-=Fe(OH)3+5OH-,正極上生成氫氧根離子導致溶液中氫氧根離子濃度增大,溶液的堿性增強。
答案為:正。


 手拉手全優練考卷系列答案
手拉手全優練考卷系列答案科目:高中化學 來源: 題型:
【題目】已知磷酸分子(![]() )中的三個氫原子都可以與重水分子(D2O)中的 D 原子發生氫交換。又知次磷酸( H3 PO2)也可與 D2O 進行氫交換,但次磷酸鈉(NaH2PO2)卻不能與 D2O 發生氫交換。下列說法正確的是
)中的三個氫原子都可以與重水分子(D2O)中的 D 原子發生氫交換。又知次磷酸( H3 PO2)也可與 D2O 進行氫交換,但次磷酸鈉(NaH2PO2)卻不能與 D2O 發生氫交換。下列說法正確的是
A.H3 PO2 屬于三元酸B.NaH2PO2 溶液可能呈酸性
C.NaH2PO2 屬于酸式鹽D.H3 PO2 的結構式為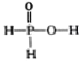
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向淀粉-碘化鉀的酸性溶液中加入少量 H2O2 溶液,溶液立即變藍,再向藍色溶液中緩慢通入足量的 SO2, 藍色逐漸消失。下列判斷不正確的是
A.根據上述實驗判斷 H2O2 和 SO2 反應能生成強酸
B.藍色逐漸消失,體現了 SO2 的漂白性
C.SO2 中 S 原子采取 sp2雜化方式,分子的空間構型為 V 型
D.H2O2是一種含有極性鍵和非極性鍵的極性分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】固體離子導體依靠離子遷移傳導電流。如圖是一種固體電池,Ag+可以在RbAg4I5晶體中遷移,空氣中的O2透過聚四氟乙烯膜與AlI3反應生成I2,Ag和I2作用形成原電池。下列說法錯誤的是( )
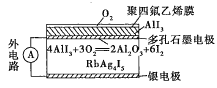
A.I2與Ag反應屬于放熱反應
B.Ag+從多孔石墨電極向銀電極移動
C.多孔石墨電極為正極,銀電極為負極
D.銀電極的電極反應式為Ag-e-=Ag+
查看答案和解析>>
科目:高中化學 來源: 題型:
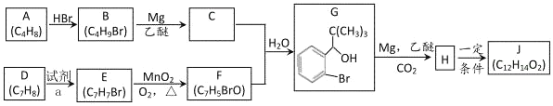
【題目】丁苯酞(J)是用于腦血管疾病治療的藥物。它的某種合成路線如下:
已知: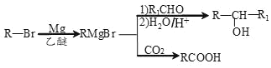
請回答下列問題:
(1)E 的名稱為________,F 中所含官能團名稱為_______,H→J 的反應類型為_______。
(2)B 生成 A 的方程式_______。
(3)X 是 H 的同系物,相對分子質量比 H 小 56。滿足下列條件 X 的同分異構體共有_______種。
①能發生水解反應;②能發生銀鏡反應;③能與氯化鐵溶液發生顯色反應。 其中核磁共振氫譜圖中有五個吸收峰的同分異構體的結構簡式為_______。
(4)利用題中信息所學知識,寫出以甲烷和苯甲醛為原料,合成苯乙烯的路線流程圖(其他無機試 劑自選)_______。合成路線流程圖表達方法例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四氫呋喃是常用的有機溶劑,可由有機物A(分子式為C4H8O)通過下列路線制得。
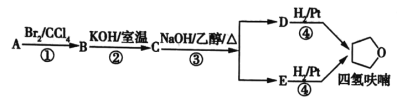
已知:R1X+R2OH![]() R1OR2+HX。
R1OR2+HX。
下列說法正確的是( )
A.C中含有的官能團僅為醚鍵
B.A的結構簡式是CH3CH=CHCH2OH
C.D和E均能使酸性高錳酸鉀溶液退色
D.①③的反應類型分別為加成反應、取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】交警用三氧化鉻(CrO3)硅膠可以查酒駕。元素Cr的幾種化合物轉化關系如圖所示,下列判斷正確的是
CrO3固體![]() K2CrO4溶液
K2CrO4溶液![]() K2Cr2O7溶液
K2Cr2O7溶液![]() CrO2Cl2+COCl2
CrO2Cl2+COCl2
A.反應①表明CrO3有酸性氧化物的性質
B.CrO42-在堿性溶液中不能大量存在
C.只有反應③為氧化還原反應
D.基態鉻原子的價電子排布式為3d44s2
查看答案和解析>>
科目:高中化學 來源: 題型:
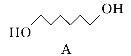
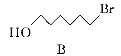
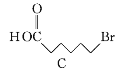
【題目】化合物N具有鎮痛、消炎等藥理作用,其合成路線如下:
![]()
![]()
 →
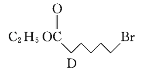
→
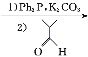
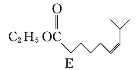
![]()
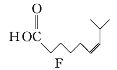
![]()
![]()

(1)A的系統命名為___________,E中官能團的名稱為__________________。
(2)A→B的反應類型為________,從反應所得液態有機混合物中提純B的常用方法為___________________________。
(3)C→D的化學方程式為____________________________________________。
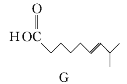
(4)參照上述合成路線,以![]() 為原料,采用如下方法制備醫藥中間體
為原料,采用如下方法制備醫藥中間體![]() 。
。
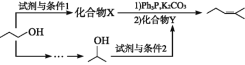
該路線中試劑與條件1為_______________,X的結構簡式為___________________;試劑與條件2為______________________,Y的結構簡式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是重要的化工原料,利用合成氣(CO、H2、CO2)在催化劑的作用下合成甲醇,可能發生的反應如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.77 kJ/mol K2
CH3OH(g) ΔH2=-90.77 kJ/mol K2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3 K3
CO(g)+H2O(g) ΔH3 K3
(1)反應③的ΔH3=________,化學平衡常數K3與K1、K2的代數關系是K3=_____。
(2)要使反應②的速率和轉化率都增大,需要改變的條件是___________。在5MPa下,要提高反應②的轉化率,可采取的措施有__________、_________(答兩條)。
(3)若反應①在恒容密閉容器中進行,下列可以判斷該反應達到平衡的是_______(填標號)。
A.v正(H2)=v逆(CH3OH) B.混合氣壓強不變
C.c(H2)與c(H2O)比值不變 D.混合氣密度不變
(4)在一定溫度和催化劑存在下,向1L密閉容器中充入1molCO2和3molH2發生反應①。當CO2的平衡轉化率為50%時,產物甲醇的體積分數為________,該溫度下,正反應的平衡常數K=__________。若向容器中再充入0.5molH2和0.5molH2O(g),其他條件不變時平衡_______移動(填“正向”“逆向”“不”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com