
【題目】下圖表示幾種無機物之間的轉換關系。其中A、B均為黑色粉末,B為非金屬單質,C為無色無毒氣體,D為金屬單質,E是紅棕色氣體,G是具有漂白性的氣體,H的水溶液呈藍色。

請回答下列問題:
(1)A的化學式是 ,C的電子式是 ,Y的名稱是 。
(2)反應1的化學方程式為 。
(3)19.2g的D與足量的一定濃度X的溶液反應,將所得到的氣體與 LO2(標準狀況下)混合,恰好能被水完全吸收。
【答案】(1)CuO;![]() ;濃硫酸;(2)C+4HNO3(濃)
;濃硫酸;(2)C+4HNO3(濃)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(3)3.36。
【解析】
試題分析:根據已知條件可確定A是CuO,B是C;C是CO2,D是Cu,E是NO2,F是H2O,G是SO2,H是CuSO4,I是NO。X是HNO3,Y是H2SO4。(1)A的化學式是CuO,C的電子式是![]() ,Y的名稱是濃硫酸;(2)反應1是碳與濃硝酸在加熱時發生氧化還原反應,產生CO2、NO2、H2O,根據電子守恒、原子守恒,可得反應的化學方程式為C+4HNO3(濃)
,Y的名稱是濃硫酸;(2)反應1是碳與濃硝酸在加熱時發生氧化還原反應,產生CO2、NO2、H2O,根據電子守恒、原子守恒,可得反應的化學方程式為C+4HNO3(濃)![]() CO2↑+4NO2↑+2H2O;(3)19.2g的Cu的物質的量是n(Cu)=19.2g÷64g/mol=0.3mol,該物質與足量的一定濃度濃硝酸X的溶液發生反應:Cu+ 4HNO3(濃)=Cu(NO3)2+NO2↑+2H2O,將所得到的氣體與一定體積的O2混合,恰好能被水完全吸收,根據電子轉移數目相等,可知反應過程中電子轉移的物質的量是n(e-)=0.3mol×2=0.6mol,則反應的氧氣的物質的量是n(O2)=0.6mol÷4=0.15mol,則在標準狀況下氧氣的體積是V(O2)= 0.15mol×22.4L/mol=3.36L。
CO2↑+4NO2↑+2H2O;(3)19.2g的Cu的物質的量是n(Cu)=19.2g÷64g/mol=0.3mol,該物質與足量的一定濃度濃硝酸X的溶液發生反應:Cu+ 4HNO3(濃)=Cu(NO3)2+NO2↑+2H2O,將所得到的氣體與一定體積的O2混合,恰好能被水完全吸收,根據電子轉移數目相等,可知反應過程中電子轉移的物質的量是n(e-)=0.3mol×2=0.6mol,則反應的氧氣的物質的量是n(O2)=0.6mol÷4=0.15mol,則在標準狀況下氧氣的體積是V(O2)= 0.15mol×22.4L/mol=3.36L。


 口算題卡北京婦女兒童出版社系列答案
口算題卡北京婦女兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用。右圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:

(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則在X極附近觀察到的現象是________________________________,Y電極上的電極反應式為_______________。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則X電極的電極反應式是______________________,Y電極的材料是_______。
(3)如要用電解方法實現鐵上鍍銀,電解液a選用_________溶液,則X電極的材料是_______,Y電極的電極反應式是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以某菱錳礦(含MnCO3、SiO2、FeCO3和少量Al2O3等)為原料通過以下方法可獲得碳酸錳粗產品。
(已知:Ksp(MnCO3)=2.2×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38)
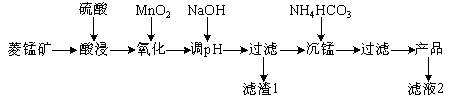
(1)濾渣1中,含鐵元素的物質主要是 (填化學式,下同);加NaOH調節溶液的pH約為5,如果pH過大,可能導致濾渣1中 含量減少。
(2)濾液2中,+1價陽離子除了H+外還有 (填離子符號)。
(3)取“沉錳”前溶液a mL于錐形瓶中,加入少量AgNO3溶液(作催化劑)和過量的1.5%(NH4)2S2O8溶液,加熱,Mn2+被氧化為MnO,反應一段時間后再煮沸5 min[除去過量的(NH4)2S2O8],冷卻至室溫。選用適宜的指示劑,用b mol·L-1的(NH4)2Fe(SO4)2標準溶液滴定至終點,消耗(NH4)2Fe(SO4)2標準溶液V mL。
①Mn2+與(NH4)2S2O8反應的還原產物為 (填化學式)。
②“沉錳”前溶液中c(Mn2+)= mol·L-1。
(4)其他條件不變,“沉錳”過程中錳元素回收率與NH4HCO3初始濃度(c0)、反應時間的關系如下圖所示。

①NH4HCO3初始濃度越大,錳元素回收率越 (填“高”或“低”),簡述原因 。
②若溶液中c(Mn2+)=1.0 mol·L-1,加入等體積1.8 mol·L-1 NH4HCO3溶液進行反應,計算20~40 min內v(Mn2+)= 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“司樂平”是治療高血壓的一種臨床藥物,其有效成分M的結構簡式如圖所示。

(1)下列關于M的說法正確的是______(填序號)。
a.屬于芳香族化合物 b.遇FeCl3溶液顯紫色
c.能使酸性高錳酸鉀溶液褪色 d.1molM完全水解生成2mol醇
(2)肉桂酸是合成M的中間體,其一種合成路線如下:

①烴A的名稱為______。步驟I中B的產率往往偏低,其原因是__________。
②步驟II反應的化學方程式為______________。
③步驟III的反應類型是________。
④肉桂酸的結構簡式為__________________。
⑤C的同分異構體有多種,其中苯環上有一個甲基的酯類化合物有_____種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴A是有機化學工業的基本原料,其產量可以用來衡量一個國家的石油化工發展水平,A還是一種植物生長調節劑,A可發生如圖所示的一系列化學反應,其中①②③屬于同種反應類型。根據如圖回答下列問題:

(1)寫出A、B、C、D的結構簡式:
A________,B________,C________,D________。
(2)寫出、、、④四步反應的化學方程式,并注明反應類型
____________________,反應類型________。
____________________,反應類型________。
____________________,反應類型________。
④____________________,反應類型________。
(4)烴A的燃燒反應方程式___________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳、氮、硫是中學化學重要的非金屬元素,在工農業生產中有廣泛的應用。
(1)用于發射“天宮一號”的長征二號火箭的燃料是液態偏二甲肼(CH3)2N-NH2,氧化劑是液態四氧化二氮。二者在反應過程中放出大量能量,同時生成無毒、無污染的氣體。已知室溫下,1 g燃料完全燃燒釋放出的能量為42.5kJ,請寫出該反應的熱化學方程式_________________。
(2)298 K時,在2L恒容密閉容器中發生反應:2NO2(g)![]() N2O4(g)ΔH=-a kJ·mol-1 (a>0)。N2O4的物質的量濃度隨時間變化如圖1。達平衡時,N2O4的濃度為NO2的2倍,回答下列問題。
N2O4(g)ΔH=-a kJ·mol-1 (a>0)。N2O4的物質的量濃度隨時間變化如圖1。達平衡時,N2O4的濃度為NO2的2倍,回答下列問題。

①298k時,該反應的平衡常數為________。
②在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖2所示。
下列說法正確的是( )
a.A、C兩點的反應速率:A>C
b.B、C兩點的氣體的平均相對分子質量:B<C
c.A、C兩點氣體的顏色:A深,C淺
d.由狀態B到狀態A,可以用加熱的方法
③若反應在398K進行,某時刻測得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,則此時V(正) V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析試劑、醫藥、電子工業中用途廣泛。現向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH與NaOH溶液體積的關系曲線如圖3所示。試分析圖中a、b、c、d、e五個點,
①水的電離程度最大的是__________(填“a”“b”“c”“d”或“e”,下同)
②其溶液中c(OH-)的數值最接近NH3·H2O的電離常數K數值的是 ;
③在c點,溶液中各離子濃度由大到小的排列順序是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.一定溫度下,某容積為2L的密閉容器內,某一反應中M、N的物質的量隨反應時間變化的曲線如圖,依圖所示:

(1)該反應的化學方程式是 。
(2)在圖上所示的三個時刻中, (填t1、t2或t3)時刻達到化學反應限度。
II.一定溫度下將6mol的A及6molB混合于2L的密閉容器中,發生如下反應:3A(g)+B(g)![]() xC(g) + 2D(g),經過5分鐘后反應達到平衡,測得A的轉化率為60﹪,C的平均反應速率是0.36mol/(Lmin)。
xC(g) + 2D(g),經過5分鐘后反應達到平衡,測得A的轉化率為60﹪,C的平均反應速率是0.36mol/(Lmin)。
求:(1)平衡時D的濃度= mol/L。
(2)B的平均反應速率υ(B)= mol/( L.min)。
(3)x= 。
(4)開始時容器中的壓強與平衡時的壓強之比為 。(化為最簡整數比)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙苯是一種用途廣泛的有機原料,可制備多種化工產品。
(一)制備苯乙烯(原理如反應I所示):

(1)部分化學鍵的鍵能如下表所示:

根據反應I的能量變化,計算x= ____。
(2)工業上,在恒壓設備中進行反應I時,常在乙苯蒸氣中通入一定量的水蒸氣。用化學平衡理論解釋通入水蒸氣的原因為____ 。
(3)從體系自由能變化的角度分析,反應I在____(填“高溫”或“低溫”)下有利于其自發進行。
(二)制備α-氯乙基苯(原理如反應II所示):

(4)T℃時,向10 L恒容密閉容器中充人2mol乙苯(g)和2 mol Cl2(g)發生反應Ⅱ,5 min時達到平衡,乙苯和Cl2、α-氯乙基苯和HCl的物質的量濃度(c)隨時間(t)變化的曲線如圖l所示:

①0—5 min內,以HCl表示的該反應速率v(HCl)=_____________。
②T℃時,該反應的平衡常數K=_____________。
③6 min時,改變的外界條件為_____________。
④10 min時,保持其他條件不變,再向容器中充人1moI乙苯、1 mol Cl2、1 mol α-氯乙基苯和l mol HCl,12 min時達到新平衡。在圖2中畫出10-12 min,Cl2和HCl的濃度變化曲線(曲線上標明Cl2和HC1);0—5 min和0—12 min時間段,Cl2的轉化率分別用α1、α2表示,則αl α2(填“>”、“<”或“=”)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原子序數依次增大的A、B、C、D、E、F六種元素。其中A的基態原子有3個不同能級,各能級中的電子數相等;C的基態原子2p能級上的未成對電子數與A原子的相同;D為它所在周期中原子半徑最大的主族元素;E、F和C位于同一主族,F處于第一個長周期。
(1)F原子基態的外圍核外電子排布式為______________________________;
(2)由A、B、C形成的離子CAB-與AC2互為等電子體,則CAB-的結構式為_______________;
(3)在元素A與E所形成的常見化合物中,A原子軌道的雜化類型為_______________;
(4)由B、C、D三種元素形成的化合物晶體的晶胞如圖所示,則該化合物的化學式為_________;

(5)PM2.5富含大量的有毒、有害物質,易引發二次光化學煙霧污染,光化學煙霧中含有NOx、CH2=CHCHO、HCOOH、CH3COONO2(PAN)等二次污染物。
①下列說法正確的是__________________;
A.N2O為直線型分子
B.C、N、O的第一電離能依次增大
C.CH2=CH一CHO分子中碳原子均采用sp2雜化
D.相同壓強下,HCOOH沸點比CH3OCH3高,說明前者是極性分子,后者是非極性分子
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H20)5]S04,該配合物中心離子的配體為_____________,其中提供空軌道的是__________________(填微粒符號)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com