
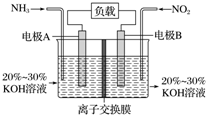
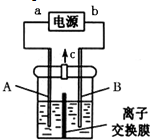
 利用反應6NO2+8NH3═7N2+12H2O構成電池的方法,既能實現有效消除氮氧化物的排放,減輕環境污染,又能充分利用化學能,裝置如圖所示,下列說法不正確的是( )
利用反應6NO2+8NH3═7N2+12H2O構成電池的方法,既能實現有效消除氮氧化物的排放,減輕環境污染,又能充分利用化學能,裝置如圖所示,下列說法不正確的是( )| A. | 電子從右側電極經過負載后流向左側電極 | |
| B. | 為使電池持續放電,離子交換膜需選用陰離子交換膜 | |
| C. | 電極A極反應式為2NH3-6e-+6OH-═N2+6H2O | |
| D. | 當有4.48 L NH3 (標準狀況)反應時,轉移電子為0.6 mol |
分析 根據方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合價由+4價變為0價、NH3中N元素化合價由-3價變為0價,所以NO2發生還原反應、NH3發生氧化反應,則A是正極、B是負極,負極電極方程式為2NH3-6e-+60H-=N2+6H2O,正極反應式為2NO2+8e-+4H2O=80H-+N2,據此分析解答.
解答 解:根據方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合價由+4價變為0價、NH3中N元素化合價由-3價變為0價,所以NO2發生還原反應、NH3發生氧化反應,則A是正極、B是負極,負極電極方程式為2NH3-6e-+60H-=N2+6H2O,正極反應式為2NO2+8e-+4H2O=80H-+N2,
A.電子從負極沿導線流向正極,則電子從左側電極經過負載后流向右側電極,故A錯誤;
B.原電池工作時,陰離子向負極移動,為使電池持續放電,離子交換膜需選用陰離子交換膜,防止二氧化氮反應生成硝酸鹽和亞硝酸鹽,導致原電池不能正常工作,故B正確;
C.電極A極反應式為2NH3-6e-+6OH-═N2+6H2O,故C正確;
D.電極A極反應式為2NH3-6e-+6OH-═N2+6H2O,當有4.48 L NH3 (標準狀況)反應時,參加反應的氨氣物質的量為0.2mol,轉移電子物質的量=0.2mol×[0-(-3)]=0.6 mol,故D正確;
故選A.
點評 本題考查化學電源新型電池,為高頻考點,明確化學反應中化合價升降與正負極的關系是解本題關鍵,難點是電極反應式的書寫,注意電子流向判斷,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 100℃時,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 | |
| B. | 25℃時,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等體積混合,所得溶液的pH=7 | |
| C. | 25℃時,0.2 mol/L NaOH溶液與0.2 mol/L H2SO4恰好中和,所得溶液的pH<7 | |
| D. | 25℃時,pH=12的氨水和pH=2的H2SO4等體積混合,所得溶液的pH>7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉浮在水面上 | B. | 金屬鈉形成小球狀 | ||
| C. | 金屬鈉在水面上迅速游動 | D. | 反應后的溶液呈現紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 四氯化碳分子的比例模型: | B. | 如圖所示一定代表丙烯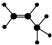 | ||
| C. | 12C32S2比12C34S2更易揮發 | D. | O${\;}_{2}^{2-}$電子式為: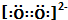 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
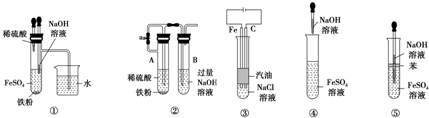
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②③④⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO(g)的燃燒熱是283.0 kJ/mol,則表示CO(g)燃燒熱的熱化學方程式為:CO (g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0 kJ•mol-1 | |
| B. | 稀鹽酸和稀氫氧化鈉溶液反應的中和熱為57.3 kJ•mol-1,則表示稀硫酸與稀氫氧化鉀溶液中和熱的熱化學方程式為:$\frac{1}{2}$H2SO4(l)+KOH(l)═$\frac{1}{2}$K2SO4(l)+H2O(l);△H=-57.3 kJ•mol-1 | |
| C. | 已知H-H鍵鍵能為436 kJ•mol-1,H-N鍵鍵能為391 kJ•mol-1,根據化學方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1,則N≡N鍵的鍵能約為946kJ•mol-1 | |
| D. | 一定條件下,反應2CO(g)═CO2(g)+C(s)可自發進行,則該反應的△H<0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 加“碘”食鹽實際添加的是碘酸鉀.以石墨和鐵為電極,以KI溶液為電解液在一定條件下電解可制得KIO3,其簡易裝置如圖所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通電前若加入少量淀粉溶液,通電后發現右側溶液變藍色,一段時間后藍色逐漸變淺.
加“碘”食鹽實際添加的是碘酸鉀.以石墨和鐵為電極,以KI溶液為電解液在一定條件下電解可制得KIO3,其簡易裝置如圖所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通電前若加入少量淀粉溶液,通電后發現右側溶液變藍色,一段時間后藍色逐漸變淺.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.6 | B. | 1.6 | C. | 3.2 | D. | 3.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com