
 ,則其中鋁原子的雜化方式為sp2.若氮化鋁可由(CH3)3Al 和 NH3在一定條件下反應制得,反應的方程式為:(CH3)3Al+NH3$\frac{\underline{\;一定條件\;}}{\;}$AlN+3CH4 ,該反應與取代反應有機反應類型相似(填反應名稱).
,則其中鋁原子的雜化方式為sp2.若氮化鋁可由(CH3)3Al 和 NH3在一定條件下反應制得,反應的方程式為:(CH3)3Al+NH3$\frac{\underline{\;一定條件\;}}{\;}$AlN+3CH4 ,該反應與取代反應有機反應類型相似(填反應名稱).分析 (1)氨氣分子為三角錐形;氨氣分子與水分子之間形成氫鍵;
(2)元素非金屬性越強,對應氫化物越穩定;
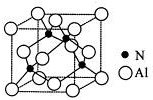
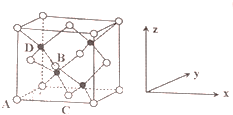
(3)由AlN的晶胞結構可知,一個N原子與距離最近的四個Al原子成鍵,每個鋁和氮周圍都有四個共價鍵,都達八電子穩定結構,而鋁原子最外層原來只有三個電子,氮原子最外層有5個電子,每個N原子都形成1個配位鍵;以頂點Al原子研究,與之緊鄰的鋁原子處于面心位置;
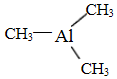
(4)(CH3)3Al為非極性分子,Al原子與3個甲基形成平面正三角形結構;晶胞中晶胞中N原子數目為4、Al原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮化鋁化學式為AlN,可由(CH3)3Al和NH3在一定條件下反應制得,由元素守恒可知還生成甲烷;
(5)等電子體的結構相似,原子總數、價電子總數也相等,將晶胞中Al原子、N原子可以替換為碳原子得到其等電子體;
氮化鋁、氮化硅均屬于原子晶體,鍵長越短,共價鍵越穩定,物質的硬度越大.
解答 解:(1)NH3的空間構型為三角錐形;NH3極易溶于水的主要原因:氨氣分子與水分子之間形成氫鍵,
故答案為:三角錐形;氨氣分子與水分子之間形成氫鍵;
(2)元素非金屬性越強,等于氫化物越穩定,由于氧元素非金屬性比硅的強,故氫化物穩定性:H2O>SiH4,
故答案為:>;氧元素非金屬性比硅的強;
(3)由AlN的晶胞結構可知,一個N原子與距離最近的四個Al原子成鍵,每個鋁和氮周圍都有四個共價鍵,都達八電子穩定結構,而鋁原子最外層原來只有三個電子,氮原子最外層有5個電子,每個N原子都形成1個配位鍵,圖中4 個氮原子共形成4個配位鍵,氮原子的配位數為4;
以頂點Al原子研究,與之緊鄰的鋁原子處于面心位置,每個頂點為8個晶胞共用,每個面為2個晶胞共用,故每個鋁原子周圍緊鄰的鋁原子數目為$\frac{8×3}{2}$=12,
故答案為:4;4;12;
(4)(CH3)3Al為非極性分子,Al原子與3個甲基形成平面正三角形結構,Al原子采取sp2雜化,
晶胞中晶胞中N原子數目為4、Al原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮化鋁化學式為AlN,可由(CH3)3Al和NH3在一定條件下反應制得,由元素守恒可知還生成甲烷,反應方程式為:(CH3)3Al+NH3$\frac{\underline{\;一定條件\;}}{\;}$AlN+3CH4 ,該反應與機反應中取代反應類型相似,
故答案為:sp2;(CH3)3Al+NH3$\frac{\underline{\;一定條件\;}}{\;}$AlN+3CH4 ;取代反應;
(5)等電子體的結構相似,原子總數、價電子總數也相等,將晶胞中Al原子、N原子可以替換為碳原子得到其等電子體,則其等電子體為金剛石等;
氮化鋁、氮化硅均屬于原子晶體,由于Si原子半徑小于Al的原子半徑,故N-Si的鍵長比N-Al的短,故N-Si鍵更穩定,氮化硅的硬度更大,
故答案為:金剛石;氮化硅.
點評 本題是對物質結構的考查,涉及元素周期律應用、微粒構型判斷、晶胞結構與計算、配位鍵、等電子體、晶體類型與性質等,題目培養學生分析能力、知識遷移運用能力,難度較大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 次硫酸氫鈉甲醛(aNaHSO2•bHCHO•cH2O)俗稱吊白塊,有較強的還原性.它常溫下比較穩定,在120℃以上分解成亞硝酸鹽.以Na2SO3、SO2、HCHO和鋅粉為原料可制備次硫酸氫鈉甲醛.實驗步驟如下:
次硫酸氫鈉甲醛(aNaHSO2•bHCHO•cH2O)俗稱吊白塊,有較強的還原性.它常溫下比較穩定,在120℃以上分解成亞硝酸鹽.以Na2SO3、SO2、HCHO和鋅粉為原料可制備次硫酸氫鈉甲醛.實驗步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將經過無害化處理的生活污水排放到漓江中 | |
| B. | 漓江沿岸不得開設造紙廠等污染企業 | |
| C. | 定期投放水生動物優化漓江生態 | |
| D. | 使用含磷洗滌劑且將洗滌后的廢水排放到漓江中 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 ,W的氣態氫化物穩定性比H2O(g)弱(填“強”或“弱”).
,W的氣態氫化物穩定性比H2O(g)弱(填“強”或“弱”).查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
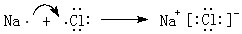 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | HA物質的量濃度(mol•L-1) | NaOH物質的量濃度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com