
【題目】孔雀石是含銅的碳酸鹽礦物,主要成分為 Cu2(OH)2CO3,工業上以孔雀石(主要雜質有FeCO3、FeO、SiO2)制備膽礬的一般流程如下:
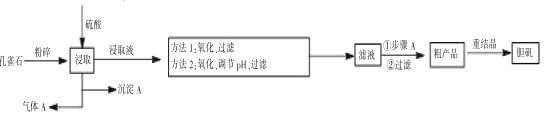
注:重結晶目的是為了除盡Fe3+
回答下列問題:
(1)寫出氣體A 的電子式______________。
(2)方法 1 的原理是用微酸性的高錳酸鉀溶液將二價鐵氧化為 Fe(OH)3,使之與 MnO2 共沉淀,易于過濾,除鐵效果好,稍有過量,溶液即顯微紅色,便于掌握。稍過量的高錳酸鉀會自動分解,產生 MnO2 和一種無毒的氣體,請完善此反應的離子反應方程式:_____MnO4- +________H+ = __MnO2↓ + ____+ _____
(3)方法 1 的不足之處是在酸性條件下會發生副反應__________________ (寫出離子方程式),產物Mn2+進入溶液,需要后續步驟除去,同時 Fe3+水解也不易徹底。因而實際生產中更多采用的是方法 2,用過氧化氫作為氧化劑,優點是____。氧化后調節pH 沉淀出氫氧化鐵,但需注意pH 不可過高,否則造成的影響是_____。
(4)若在實驗室進行步驟A 操作,需要用到的硅酸鹽儀器有 _________________ 。
(5)CuSO4·5H2O 含量的測定:稱取 0.5g 樣品,溶于水,移入 100mL 容量瓶中,稀釋至刻度,量取 25.00mL,稀釋至 100mL,加入10mL 氨-氯化銨緩沖溶液(pH=10)及 0.2g 紅紫酸銨混合指示劑,搖勻,用濃度為 cmol·L-1 EDTA 標準溶液滴定至溶液呈紫藍色不變,重復三次,平均消耗的標準溶液體積為VmL。 (EDTA 能與大多數金屬離子形成穩定的 1:1 絡合物,是絡合滴定中的常用滴定試劑)
①計算CuSO4·5H2O 質量分數 ______________。
②若不進行重結晶操作,計算出的質量分數結果會__________。(填偏低、偏高或者無影響)。
【答案】![]() 4 4 4 3O2↑ 2H2O MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O 還原產物為水,不引入其他雜質離子 Cu2+水解程度增大,產率降低 酒精燈、蒸發皿、玻璃棒 2cV×100% 偏高
4 4 4 3O2↑ 2H2O MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O 還原產物為水,不引入其他雜質離子 Cu2+水解程度增大,產率降低 酒精燈、蒸發皿、玻璃棒 2cV×100% 偏高
【解析】
孔雀石主要成分為 Cu2(OH)2CO3,主要雜質有FeCO3、FeO、SiO2,粉碎后加入硫酸除SiO2均可溶于硫酸,所以得到的沉淀A為SiO2;孔雀石的主要成分和某些雜質中都含有碳酸根,則在和硫酸反應時會生成二氧化碳氣體,所以氣體A為CO2;得到的浸取液中主要金屬陽離子有Fe2+、Fe3+、Cu2+;之后通過方法一或方法二進行除雜,兩種方法共同點都是先將亞鐵離子氧化成鐵離子再進行除雜;之后進行過濾得到硫酸銅溶液,經蒸發濃縮、冷卻結晶、過濾得到粗產品,再通過重結晶進行進一步除雜。
(1)根據分析可知氣體A為CO2,其電子式為![]() ;
;
(2)根據題目信息可知過量的高錳酸鉀自行分解過程中還原產物為MnO2,根據元素的價態變化規律,K元素和H元素化合物價已為最高價不能再升高,則只能是氧元素化合價生高,即氧化產物為O2,根據電子守恒和元素守恒可得方程式為:4MnO4- +4H+ =4MnO2↓ +3O2↑+2H2O;
(3)根據題目信息可知酸性條件下高錳酸鉀氧化亞鐵離子時還原產物可能為Mn2+,根據電子守恒和元素守恒可知方程式為MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;過氧化氫做氧化劑,其還原產物為水,既不污染環境也不引入新的雜質;pH過高,促進銅離子水解,產生氫氧化銅沉淀,產率降低;
(4)步驟A為蒸發濃縮、冷卻結晶,用到的硅酸鹽儀器有酒精燈、蒸發皿、玻璃棒;
(5)①根據題目信息“EDTA 能與大多數金屬離子形成穩定的 1:1 絡合物”可知滴定過程中n(Cu2+)=n(EDTA),則待測液中n(Cu2+)=V×10-3L×cmol·L-1 =cV×10-3mol,所以樣品中所含n(CuSO4·5H2O)= Vc×10-3mol×![]() =4cV×10-3mol,所以CuSO4·5H2O 質量分數為
=4cV×10-3mol,所以CuSO4·5H2O 質量分數為![]() = 2cV×100%;
= 2cV×100%;
②若不進行重結晶,則會有Fe3+,導致單位質量的樣品消耗更多的EDTA標準液,測得的CuSO4·5H2O 質量分數偏高。


 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】氯仿![]() 常因保存不慎而被氧化,產生劇毒物光氣
常因保存不慎而被氧化,產生劇毒物光氣![]() :
:![]() ,下列說法不正確的有
,下列說法不正確的有![]()
![]()

A. ![]() 分子為含極性鍵的非極性分子
分子為含極性鍵的非極性分子
B. ![]() 分子中含有3個
分子中含有3個![]() 鍵、一個
鍵、一個![]() 鍵,中心C原子采用
鍵,中心C原子采用![]() 雜化
雜化
C. ![]() 分子中所有原子的最外層電子都滿足8電子穩定結構
分子中所有原子的最外層電子都滿足8電子穩定結構
D. 使用前可用硝酸銀稀溶液檢驗氯仿是否變質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在 20 ℃時,某氣態烴與氧氣混合,裝入密閉容器中,點燃爆炸后,又恢復到 20 ℃, 此時容器內氣體的壓強為反應前的一半,經 NaOH 溶液吸收后,容器內幾乎成真空,此 烴的分子式可能是( )
A.CH4B.C2H6C.C3H6D.C3H8
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯甲酸乙酯(C9H10O2)的別名為安息香酸乙酯。它是一種無色透明液體,不溶于水,有芳香氣味,用于配制香水、香精和人造精油,大量用于食品工業中,也可用作有機合成中間體、溶劑等。其制備方法為: ![]() +CH3CH2OH
+CH3CH2OH![]()
 +H2O
+H2O
已知:苯甲酸在100℃會迅速升華。相關有機物的性質如表所示。
名稱 | 相對分子質量 | 顏色、狀態 | 沸點/℃ | 密度/(g﹒cm-3) |
苯甲酸 | 122 | 無色片狀晶體 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 無色澄清液體 | 212.6 | 1.05 |
乙醇 | 46 | 無色澄清液體 | 78.3 | 0.7893 |
環己烷 | 84 | 無色澄清液體 | 80.8 | 0.7318 |
實驗步驟如下:
①在圓底瓶中加入12.20g苯甲酸,25mL95%的乙醇(過量),20mL環己烷以及4mL濃硫酸,混合均勻并加入沸石,按如圖所示裝置裝好儀器,控制溫度在65~70℃加熱回流2h。利用分水器不斷分離除去反應生成的水,回流環己烷和乙醇。

②反應結束,打開旋塞放出分水器中的液體后,關閉旋塞,繼續加熱,至分水器中收集到的液體不再明顯增加,停止加熱。
③將燒瓶內反應液倒入盛有適量水的燒杯中,分批加入Na2CO3至溶液呈中性。用分液漏斗分出有機層,水層用25mL乙醚,靜置,過濾,對濾液進行蒸餾,低溫蒸出乙醚和環己烷后,繼續升溫,接收210~213℃的餾分。
④檢驗合格,測得產品體積為12.86mL。
回答下列問題:
(1)在該實驗中,圓底燒瓶的容積最適合的是________(填序號)。
A. 25mL B.50mL C. 100mL D. 250mL
(2)步驟①中使用分水器不斷分離除去水的目的是___________。
(3)步驟②中應控制蒸餾的溫度為_______(填序號)。
A. 65~70℃ B. 78~80℃ C. 80~85℃ D. 215~220℃
(4)步驟③加入Na2CO3的作用是_______;若Na2CO3的加入量不足,在之后蒸餾時,蒸餾燒瓶中可見到白煙生成,產生該現象的原因是________。
(5)關于步驟③中的萃取分液操作的敘述正確的是__________(填序號)。
A. 水溶液中加入乙醚,轉移至分液漏斗中,塞上玻璃塞,分液漏斗倒轉過來,用力振搖
B. 振搖幾次后需打開分液漏斗上口的玻璃塞放氣
C. 經幾次振搖并放氣后,手持分液漏斗靜置待液體分層
D. 放出液體時,應打開上口玻璃塞或將玻璃塞上的凹槽對準漏斗口上的小孔
(6)計算可得本實驗的產率為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸二甲酯[(CH3O)2CO]是一種具有發展前景的“綠色”化工產品,電化學合成碳酸二甲酯的工作原理如圖所示(加入兩極的物質均是常溫常壓下的物質)。下列說法正確的是

A. 電解一段時間后,陰極和陽極消耗的氣體的物質的量之比為l:2
B. 石墨l極發生的電極反應為2CH3OH+CO-e-=(CH3O)2CO+H+
C. 石墨2極與直流電源正極相連
D. H+由石墨2極通過質子交換膜向石墨l極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如圖有關圖象,說法正確的是( )
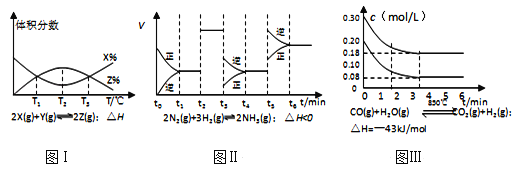
A. 由圖Ⅰ知,反應在T1、T3處達到平衡,且該反應的△H<0
B. 由圖Ⅱ知,反應在t6時刻,NH3體積分數最大
C. 由圖Ⅱ知,t3時采取降低反應體系溫度的措施
D. 圖Ⅲ表示在10L容器、850℃時的反應,由圖知,到4min時,反應放出51.6kJ的熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A.pH=l的溶液中:Ba2+、Fe3+、Cl-、SCN-
B.能使酚酞變紅的溶液:Ca2+、K+、HCO3-、CO32-
C.![]() =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D.由水電離的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 反應CO2(g)+C(s)![]() 2CO(g)的△H<0,△S>0
2CO(g)的△H<0,△S>0
B. 鋼鐵水閘可用犧牲陽極或者外加電流的陰極保護法減緩其腐蝕
C. 常溫下,KSP[Al(OH)3]=1×10-33。欲使溶液中c(Al3+)≤1×10-6 mol·L-1,需調節溶液的pH≥5
D. 常溫常壓下,11.2 L Cl2與足量鐵粉充分反應,轉移電子數為6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下用0.1mol/L NaOH溶液滴定40mL 0.1mol/LH2SO3溶液,所得滴定曲線如圖所示(忽略混合時溶液體積的變化)。下列敘述錯誤的是

A.Ka2(H2SO3)的數量級為10-8
B.若滴定到第一反應終點,可用甲基橙作指示劑
C.圖中Y點對應的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D.圖中Z點對應的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com