
| 加入試劑 | 被檢出物質 | 理由 |
| 水 | CuSO4 | CuSO4溶于水溶液顯藍色 |
| 加入試劑 | 被檢出物質 | 離子方程式 |
| CuSO4 |
| 加入試劑 | 被檢出物質 | 離子方程式 |
| MgCl2 |
分析 步驟1.KNO3、MgCL2、Ba(OH)2溶于水都得到無色透明溶液,無水CuSO4溶于水得到藍色溶液;
步驟2.氫氧化鋇能和硫酸銅溶液反應生成白色和藍色沉淀,硝酸鉀和氯化鎂和硫酸銅溶液不反應;
步驟3.硝酸鉀和氫氧化鋇溶液不反應,氯化鎂和氫氧化鋇溶液反應生成白色沉淀,
通過以上分析知,其鑒別先后順序是硫酸銅、氫氧化鋇、氯化鎂、硝酸鉀.
解答 解:步驟1.KNO3、MgCL2、Ba(OH)2溶于水都得到無色透明溶液,無水CuSO4溶于水得到藍色溶液,
該反應沒有離子方程式;
步驟2.氫氧化鋇能和硫酸銅溶液反應生成白色和藍色沉淀,硝酸鉀和氯化鎂和硫酸銅溶液不反應,離子方程式為:Cu 2++SO42-+Ba 2++2OH-=Cu(OH)2↓+BaSO4↓;
步驟3.硝酸鉀和氫氧化鋇溶液不反應,氯化鎂和氫氧化鋇溶液反應生成白色沉淀,離子方程式為
Mg 2++2OH-=Mg(OH)2↓,
通過以上分析知,其鑒別先后順序是硫酸銅、氫氧化鋇、氯化鎂、硝酸鉀,
故答案為:步驟1:
| 加入試劑 | 被檢出物質的化學式 | 離子方程式 |
| 水 | CuSO4 | CuSO4溶于水溶液顯藍色 |
| 加入試劑 | 被檢出物質的化學式 | 離子方程式 |
| CuSO4 | Ba(OH)2 | Cu 2++SO42-+Ba 2++2OH-=Cu(OH)2↓+BaSO4↓ |
| 加入試劑 | 被檢出物質的化學式 | 離子方程式 |
| Ba(OH)2 | MgCl2 | Mg 2++2OH-=Mg(OH)2↓, |
點評 本題考查了物質的鑒別及離子方程式的書寫,明確物質的性質是解本題關鍵,再結合離子產生書寫規則書寫,注意硫酸銅和氫氧化鋇反應時易漏掉部分離子的反應,為易錯點.


 手拉手全優練考卷系列答案
手拉手全優練考卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | NA個二氧化碳分子和0.5mol甲烷的質量比為11:4 | |
| B. | 1molCl2作為氧化劑得到的電子數為NA | |
| C. | 在0℃,101kPa時,11.2L氫氣中含有0.5NA個氫原子 | |
| D. | 14g氮氣中含有7NA個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4++H2O?NH3•H2O+H+ | B. | NH3•H2O?NH4++OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO和HCl | B. | H2,HCl和CO | C. | CO2,CO和HCl | D. | CO2,CO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
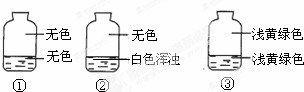 向盛有氯氣的三個集氣瓶中,分別注入約五分之一的下列液體并振蕩,觀察如圖所記錄的現象,判斷各瓶注入的液體依次是什么.( )
向盛有氯氣的三個集氣瓶中,分別注入約五分之一的下列液體并振蕩,觀察如圖所記錄的現象,判斷各瓶注入的液體依次是什么.( )| A. | AgNO3溶液、NaOH溶液、水 | B. | NaOH溶液、AgNO3溶液、水 | ||
| C. | 水、AgNO3溶液、NaOH溶液 | D. | AgNO3溶液、水、NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
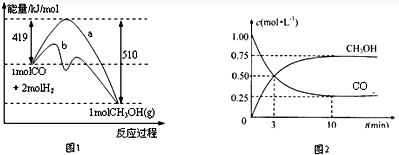
| 化學反應 | 平衡常數 | 溫度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②2H2(g)+CO2(g)?H2O+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度(K) CO2轉化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | X | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com