
【題目】工業上利用電解飽和食鹽水生產氯氣(Cl2)、燒堿和氫氣的化學方程式是2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)電解食鹽水的過程中,氧化產物是____________________,用雙線橋表示出電子轉移的方向和數目________________,題干中反應改寫成離子方程式是_____________。
(2)實驗室用______________溶液(填化學式)處理多余的氯氣,避免污染環境,寫出化學方程式___________________________________________________。
(3)電解食鹽水要求對粗食鹽水進行精制,以除去粗食鹽水中含有的泥沙和SO42-、Ca2+、Mg2+等雜質離子。精制時依次加入BaCl2溶液、Na2CO3、NaOH,充分反應后過濾,在濾液中加入鹽酸中和至中性。鹽酸與濾液反應的離子方程式__________。
【答案】Cl2 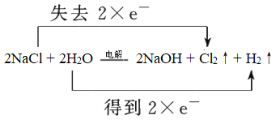 2Cl-+2H2O
2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑ NaOH Cl2+2NaOH=NaCl+NaClO+H2O H++OH-=H2O、2H++CO32-=H2O+CO2↑
2OH-+Cl2↑+H2↑ NaOH Cl2+2NaOH=NaCl+NaClO+H2O H++OH-=H2O、2H++CO32-=H2O+CO2↑
【解析】
(1)反應中氯元素化合價從-1價升高到0價,氫元素化合價從+1價降低到0價,結合電子得失守恒和方程式分析解答;
(2)根據氯氣能與堿液反應分析判斷;
(3)根據濾液中含有碳酸鈉和氫氧化鈉分析。
(1)反應中氯元素化合價從-1價升高到0價,失去1個電子,氯化鈉是還原劑,則氯氣是氧化產物;根據方程式可知反應轉移2個電子,則用雙線橋表示出電子轉移的方向和數目為 ,該反應的離子方程式為2Cl-+2H2O
,該反應的離子方程式為2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(2)氯氣有毒,實驗室用NaOH溶液處理多余的氯氣,避免污染環境,反應的化學方程式為Cl2+2NaOH=NaCl+NaClO+H2O
。
(3)電解食鹽水要求對粗食鹽水進行精制,以除去粗食鹽水中含有的泥沙和SO42-、Ca2+,Mg2+等雜質離子。精制時依次加入氯化鋇溶液,除去硫酸根離子;加入純堿,除去鈣離子和過量的鋇離子;加入燒堿,除去鎂離子,充分反應后過濾,濾液中主要含有過量的碳酸鈉和氫氧化鈉,加入鹽酸中和至中性,反應的離子方程式有H++OH-=H2O、2H++CO32-=H2O+CO2↑。


科目:高中化學 來源: 題型:
【題目】根據下列三個反應的化學方程式,判斷有關物質的還原性的強弱順序為( )
①I2+ SO2+ 2H2O =H2SO4+ 2HI ②2FeCl2+ Cl2= 2FeCl3
③2FeCl3+ 2HI =2FeCl2+ I2+ 2HCl
A. I-> Fe2+>Cl->SO2 B. Cl-> Fe2+> SO2>I-
C. Fe2+>I->Cl->SO2 D. SO2>I-> Fe2+>Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于常溫下pH=1的硝酸溶液,有關敘述:
①該溶液1mL稀釋至100mL后,pH=3
②向該溶液中加入等體積、pH=13的氫氧化鋇溶液恰好完全中和
③該溶液中硝酸電離出的c(H+)與水電離出的c(H+)之比值為1×10﹣12
④向該溶液中加入等體積、等濃度的氨水,所得溶液pH=7
其中正確的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用下列裝置進行有關Cl2的實驗。下列說法不正確的是


A. Ⅰ圖中:實驗現象證明氯氣無漂白作用,氯水有漂白作用
B. Ⅱ圖中:聞Cl2的氣味
C. Ⅲ圖中:生成棕黃色的煙
D. Ⅳ圖中:若氣球干癟,證明Cl2可與NaOH反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】試管中盛有少量白色固體,可能是銨鹽,檢驗的方法是
A.加水,將濕潤的紅色石蕊試紙放在試管口
B.加NaOH溶液,加熱,滴入酚酞試劑
C.加NaOH溶液,加熱,滴入紫色石蕊試劑
D.加NaOH溶液,加熱,將濕潤的紅色石蕊試紙放在試管口
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述錯誤的是
A. 用金屬鈉可區分乙醇和乙醚
B. 用高錳酸鉀酸性溶液可區分己烷和3-己烯
C. 用水可區分苯和溴苯
D. 用新制的銀氨溶液可區分甲酸甲酯和乙醛
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】七水硫酸鎂(MgSO4·7H2O)為白色細小四角柱狀結晶,無臭,味苦,在印染、造紙和醫藥等工業上都有廣泛的應用,利用化工廠生產硼砂的廢渣一硼鎂泥可制取七水硫酸鎂。硼鎂泥的主要成分是MgCO3,還含有其他雜質(MgO、SiO2、Fe2O3、CaO、B2O3、Al2O3、MnO等)。
表1部分陽離子以氫氧化物形式完全沉淀時溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
表2兩種鹽的溶解度(單位為g/100g水)
溫度/℃ | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | — |
硼鎂泥制取七水硫酸鎂的工藝流程如下

根據以上流程圖并參考表格數據,試回答下列問題:
(1)在酸溶過程中,想加快酸溶速度,提出兩種可行的措施_______________。
(2)沉淀A中除二氧化硅外,還含有硼酸(H3BO3),硼酸微溶于水,為一元弱酸,其酸性不來源于羥基的電離,寫出硼酸水溶液電離方程式span>_____________________
(3)經對沉淀B進行分析,發現其中含有二氧化錳,用離子方程式解釋產生二氧化錳原因:__________________。
(4)加入硼鎂泥調節pH=5~6目的是________________。
(5)得到的沉淀C的組成是_________________(填化學式),過濾Ⅲ需趁熱過濾,原因是___________。
(6)檢驗過濾Ⅱ后的濾液中是否含有Fe3+的實驗方法是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com