
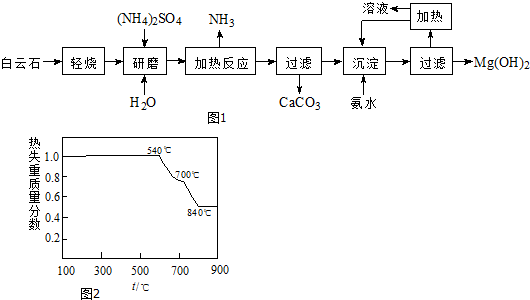
分析 白云石主要成分為MgCO3•CaCO3輕燒,從過濾中可以得到CaCO3來進行判斷,可知分解的只是碳酸鎂,研磨加入水和硫酸銨加熱,硫酸銨和氧化鎂反應生成氨氣、硫酸鎂和水,過濾后在濾液中加入氨水生成氫氧化鎂沉淀,過濾得到氫氧化鎂固體,
(1)從過濾中可以得到CaCO3來進行判斷,可知分解的只是碳酸鎂;從表中可以看出,溫度低于540℃時,物質不分解,高于840℃時,碳酸鈣和碳酸鎂都分解,因此該溫度不超過700℃;
(2)加熱的過程是放出氨氣的過程,該過程中因為氧化鎂跟水反應很少,因此涉及到的反應應該為:(NH4)2SO4+MgO$\frac{\underline{\;\;△\;\;}}{\;}$MgSO4+2NH3↑+H2O;
(3)pH=10時,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,c(Mg2+)=$\frac{{K}_{sp}[Mg(OH)_{2}]}{{c}^{2}(O{H}^{-})}$;
(4)該工藝中可以循環使用的物質是參加反應過程,反應后又生成的物質可以循環使用;
(5)減少能源消耗、便于CaCO3分離.
解答 解:白云石主要成分為MgCO3•CaCO3輕燒,從過濾中可以得到CaCO3來進行判斷,可知分解的只是碳酸鎂,研磨加入水和硫酸銨加熱,硫酸銨和氧化鎂反應生成氨氣、硫酸鎂和水,過濾后在濾液中加入氨水生成氫氧化鎂沉淀,過濾得到氫氧化鎂固體,
(1)從過濾中可以得到CaCO3來進行判斷,可知分解的只是碳酸鎂,碳酸鈣不分解,則“輕燒”后得到的固體是CaCO3、MgO;從表中可以看出,溫度低于540℃時,物質不分解,高于840℃時,碳酸鈣和碳酸鎂都分解,因此該溫度不超過700℃,
故答案為:CaCO3、MgO; 700℃;
(2)加熱的過程是放出氨氣的過程,該過程中因為氧化鎂跟水反應很少,涉及到的反應應該為(NH4)2SO4+MgO$\frac{\underline{\;\;△\;\;}}{\;}$MgSO4+2NH3↑+H2O,
故答案為:(NH4)2SO4+MgO$\frac{\underline{\;\;△\;\;}}{\;}$MgSO4+2NH3↑+H2O;
(3)pH=10時,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,c(Mg2+)=$\frac{{K}_{sp}[Mg(OH)_{2}]}{{c}^{2}(O{H}^{-})}$=$\frac{5.61×1{0}^{-12}}{(1{0}^{-4})^{2}}$mol/L=5.61×10-4mol•L-1,
故答案為:5.61×10-4mol•L-1 ;
(4)該工藝中可以循環使用的物質是參加反應過程,反應后又生成的物質可以循環使用,流程圖分析判斷(NH4)2SO4 、NH3或NH3•H2O可以循環使用,
故答案為:(NH4)2SO4、NH3或NH3•H2O;
(5)分析流程可知,傳統工藝將白云石分解為氧化鎂和氧化鈣后提取,該工藝采用輕燒白云石的方法可以減少能源消耗、便于CaCO3分離;
故答案為:減少能源消耗;便于CaCO3分離.
點評 本題考查了物質分離方法和流程理解應用,為高頻考點,側重于學生的分析能力和實驗能力的考查,題目涉及混合物分離提純、產物的分析判斷,難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | “84”消毒液有漂白和消毒作用 | |
| B. | 工業中將氯氣通入石灰乳中制取漂白粉 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 漂白粉在空氣中久置失效 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
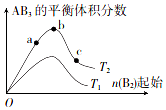 在其他條件不變時,改變某一條件對反應A2(g)+3B2(g)?2AB3(g)的化學平衡狀態的影響如圖所示(T表示溫度,n表示物質的量).下列判斷正確的是( )
在其他條件不變時,改變某一條件對反應A2(g)+3B2(g)?2AB3(g)的化學平衡狀態的影響如圖所示(T表示溫度,n表示物質的量).下列判斷正確的是( )| A. | 反應速率:a>b>c | B. | 達到平衡時A的轉化率大小:b>a>c | ||
| C. | 若T2>T1.則正反應一定是吸熱反應 | D. | 達到平衡時,n( AB3)的大小:b>a>c |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | MnS使用量越大,廢水中的Cu2+的去除率越高 | |
| B. | 該反應可將工業廢水中的Cu2+沉淀完全 | |
| C. | 往平衡體系中加入少量CuSO4固體后,c(Mn2+)變大 | |
| D. | 該反應的平衡常數K=2.0×1023 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
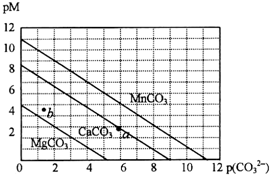 一定溫度下,三種碳酸鹽MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如下圖所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列說法正確的是( )
一定溫度下,三種碳酸鹽MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如下圖所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列說法正確的是( )| A. | M離子濃度越大,pM值越大 | |
| B. | MgCO3、CaCO3、MnCO3的Ksp依次增大 | |
| C. | b點表示MgCO3為不飽和溶液,若表示CaCO3則有沉淀析出 | |
| D. | a點可表示CaCO3的飽和溶液,且c(Ca2+)<c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
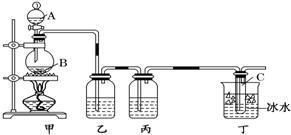
 某化學課外小組用右圖裝置制取溴苯并探究該反應的類型.先向分液漏斗中加入苯和液溴,再將混合液滴入反應器A(A下端活塞關閉)中.
某化學課外小組用右圖裝置制取溴苯并探究該反應的類型.先向分液漏斗中加入苯和液溴,再將混合液滴入反應器A(A下端活塞關閉)中. .
.| 向試管D中加入的試劑 | 能證明苯與液溴發生取代反應的現象 | |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com