
【題目】可用于治療胃酸過多的物質是
A. 碳酸氫鈉 B. 氯化鈉 C. 氯化鉀 D. 氫氧化鈉
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E均為短周期元素,非金屬元素A的最外層電子數與其周期數相等,B的成對電子與未成對電子所占據的原子軌道數相等。單質B在單質C中充分燃燒生成BC2。 D+與C2-具有相同的電子數。A在E中燃燒,產物溶于水會得到一種強酸。
(1)B在元素周期表中的位置是________,寫出一種工業制備單質E的化學方程式:_____。
(2)B、C、D組成的一種鹽中,B的質量分數為17. 91%,D的質量分數為34. 3 3%。該鹽的化學式為________,其陰離子中B原子的雜化方式為__________。
(3)由這些元素組成的某些物質的組成和結構信息如下表:
物質 | 組成和結構 |
a | A、D兩元素組成的離子化合物 |
b | 由C、D兩元素組成的含有非極性鍵的離子化合物 |
c | 化學組成為BCE2 |
a的電子式為_________;b的化學式為________;c的空間構型為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關活化分子的說法正確的是( )
A. 增大反應物濃度可以提高活化分子百分數
B. 增大體系的壓強一定能提高活化分子百分數
C. 使用合適的催化劑可以增大活化分子的能量
D. 升高溫度能提高活化分子百分數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)== CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s) △H= —489.0kJ/mol
則4Fe(s)+3O2(g)==2Fe2O3(s)的反應熱ΔH為( )
A.-1641.0kJ/mol B.+3081kJ/mol
C.+663.5kJ/mol D.-2507.0kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學式C8H10O的化合物A具有如下性質;①A+Na![]() 慢慢產生氣泡 ②A+RCOOH
慢慢產生氣泡 ②A+RCOOH![]() 有香味的產物 ③A
有香味的產物 ③A![]() 苯甲酸 ④其催化脫氫產物不能發生銀鏡反應 ⑤脫水反應的產物,經聚合反應可制得一種塑料制品(它是目前造成“白色污染”的主要污染源之一)。
苯甲酸 ④其催化脫氫產物不能發生銀鏡反應 ⑤脫水反應的產物,經聚合反應可制得一種塑料制品(它是目前造成“白色污染”的主要污染源之一)。
試回答;
(1)根據上述信息,對該化合物的結構可作出的判斷是_____________;
A.苯環上直接連有羥基 B.苯環側鏈末端有甲基
C.肯定有醇羥基 D.肯定是芳香烴
(2)化合物A的結構簡式_____________;
(3)A和金屬鈉反應的化學方程式_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 電解熔融氯化鎂可制取金屬鎂
B. 電解飽和食鹽水可制取氯氣
C. 生產普通玻璃的主要原料為石灰石、純堿和晶體硅
D. 接觸法制硫酸的硫元素主要來源于硫黃或含硫礦石
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂和鋁分別與等濃度、等體積的過量稀硫酸反應,產生氣體的體積(V)與時間(t)關系如圖。反應中鎂和鋁的 ( )
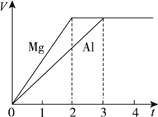
A. 摩爾質量之比為2∶3
B. 物質質量之比為3∶2
C. 物質的量之比為3∶2
D. 物質的量之比為2∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】150℃時,向如圖所示的容器(密封的隔板可自由滑動)中加入4LN2和H2的混合氣體, 在催化劑作用下充分反應(催化劑體積忽略不計),反應后恢復到原溫度。平衡后容器體積變為3.4L,容器內氣體對相同條件的氫氣的相對密度為5。
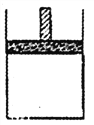
(1)反應前混合氣體中V(N2):V(H2)= _______, 反應達到平衡后V(NH3)= _______L,該反應中N2轉化率為______。
(2)向平衡后的容器中充入0. 2mol的NH3,一段對間后反應再次達到平衡,恢復到150℃時測得此過程中從外界吸收了 6.44kJ的熱量;
①充入NH3時,混合氣體的密度將_________,在達到平衡的過程中,混合氣體的密度將_______(填“增大”、“減小”或“不變”);反應重新達平衡的混合氣體對氫氣的相對密度將_____5(填“ >”、“ <”或“=”)。
②下列哪些實驗現象或數據能說明反應重新到達了平衡 _______;
A.容器不再與外界發生熱交換
B.混合氣體的平均相對分子質量保持不變
C.當K( N2):V( H2):F( NH3) = 1:3:2時
D.當容器的體積不再發生變化時
③寫出該反應的熱化學方程式: __________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取等物質的量濃度的NaOH溶液兩份A和B,每份100 mL,分別向A、B中通入不等量的CO2,再繼續向兩溶液中逐滴加入0.1 mol·L-1的鹽酸,標準狀況下產生的CO2的體積與所加鹽酸體積之間的關系如圖所示,試回答下列問題:

(1)原NaOH溶液的物質的量濃度為________。
(2)曲線A表明,原NaOH溶液中通入CO2后,所得溶液加鹽酸后產生CO2氣體體積(標準狀況)的最大值為________ L。
(3)曲線A表明,原NaOH溶液中通入CO2后,所得溶液中的溶質成分是________________,其物質的量之比為________。
(4)曲線B表明,原NaOH溶液中通入CO2后,所得溶液中的溶質成分是________________,其物質的量之比為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com