
 第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表現出多種價態,含第VIA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題:
第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表現出多種價態,含第VIA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題:分析 (1)同周期元素自左而右,第一電離能呈增大趨勢;氮原子2p能級有3個電子,處于半滿穩定狀態,其第一電離能大于O;
(2)CH3CH2OH含氫鍵,使其沸點升高;
(3)硒是34號元素,基態原子核外有34個電子,根據構造原理書寫其核外電子排布式;根據分子空間構型確定其鍵角相對大小;
(4)二氧化硫分子中,中心原子S形成兩個2個σ鍵和1對孤對電子,據此判斷其中心原子的雜質方式及空間構型;
(5)①在晶胞結構中,黑顏色球代表的Cu位于體內,共4個;白顏色球代表的O有8個位于頂點、6個位于面心,利用均攤法計算出其化學式;
②根據晶胞結構可知,立方體體心的O原子周圍含有4個鐵離子,所以其配位數為4,晶體中距離最近的4個銅原子構成正四面體結構.
解答 解:(1)同周期元素自左而右,第一電離能呈增大趨勢,但是氮原子2p能級有3個電子,處于半滿穩定狀態,電子能量降低,所以第一電離能高于同周期相鄰元素的第一電離能,所以三者的第一電離能由小到大的順序為:O<N<F,
故答案為:O<N<F;
(2)CH3CH2OH含氫鍵,使其沸點升高,CH3CH2OH的沸點高于CH3OCH3的沸點,其原因是乙醇分子之間形成氫鍵,故答案為:乙醇分子之間形成氫鍵;
(3)硒是34號元素,基態原子核外有34個電子,其基態原子核外電子排布式為:1s22s22p63s23p63d104s24p4;CSe2與CO2結構相似,二氧化碳是直線型分子,H2Se分子為v型分子,所以CSe2分子內的Se-C-Se鍵角大于H2Se分子內的H-Se-H鍵角,
故答案為:1s22s22p63s23p63d104s24p4;大于;
(4)二氧化硫分子中,中心原子S形成兩個2個σ鍵、含有1對孤對電子,故雜化軌道數為3,采取sp2雜化,其空間結構為V形,
故答案為:V形;sp2;
(5)①在晶胞結構中,黑顏色球代表的Cu位于體內,共4個;白顏色球代表的O有8個位于頂點、6個位于面心,晶胞中總個數為:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,化學式可寫為CuO,
故答案為:CuO;
②氧化銅晶胞的體心的氧離子周圍包圍了4個銅離子,則其配位數為4;由于晶體中距離最近的4個銅原子與體心的氧原子距離完全相同,所以這四個Cu原子構成了正四面體結構,
故答案為:4;正四面體.
點評 本題考查了晶胞的計算、配合物的成鍵情況的判斷、元素周期律的應用等知識,題目難度較大,試題知識點較多、綜合性較強,充分考查了學生的分析、理解能力,注意掌握均攤法在計算晶胞化學式中的應用,明確配合物的成鍵情況.


 期末好成績系列答案
期末好成績系列答案 99加1領先期末特訓卷系列答案
99加1領先期末特訓卷系列答案 百強名校期末沖刺100分系列答案
百強名校期末沖刺100分系列答案 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Na2O是白色固體,和冷水作用得到O2和NaOH | |
| B. | Na2O2與水的反應中,Na2O2既是氧化劑,又是還原劑 | |
| C. | Na2O2中氧的化合價是-1價 | |
| D. | 都能與酸反應,生成鹽和水,都是堿性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名稱 | 綠礬 | 醋精 | 蘇打 | 酒精 | 銅導線 | 蔗糖 | 燒堿 |
| 主要 成分 | FeSO4 | CH3COOH | Na2CO3 | CH3CH2OH | Cu | C12H22O11 | NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 13C和14C屬于同一種元素,它們互為同位素 | |
| B. | 6Li和7Li的電子數相等,中子數也相等 | |
| C. | 14C和14N的質量數相等,它們的中子數不等 | |
| D. | 1H和2H是不同的核素,它們的質子數相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲和乙分別是C和Mg | |
| B. | 乙元素形成的某種單質可能是天然物質中硬度最大的 | |
| C. | 甲與乙處于同一主族 | |
| D. | 乙元素的單質與冷水反應很快而遇熱水則發生爆炸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
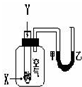 某學生用如圖所示裝置進行化學反應X+2Y═2Z能量變化情況的研究.當往試管中滴加試劑Y時,看到U型管中液面甲處降、乙處升.關于該反應的下列敘述:其中正確的是( )
某學生用如圖所示裝置進行化學反應X+2Y═2Z能量變化情況的研究.當往試管中滴加試劑Y時,看到U型管中液面甲處降、乙處升.關于該反應的下列敘述:其中正確的是( )| A. | ①③ | B. | ①④⑤ | C. | ②③⑤ | D. | ①④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com