
某校化學興趣小組設計了如下實驗裝置(圖中部分夾持儀器已略去)來測定某鐵碳合金中鐵的質量分數,并探究鐵與濃硫酸的反應。

請回答下列問題:
(1)mg鐵碳合金中加入過量濃硫酸,未點燃酒精燈前,A、B均無明顯現彖,其原因是①_____②_____
(2)點燃酒精燈,可觀察到B中的現象是_____________________,C 的作用是___________________
(3)待A中不再逸出氣體時,停止加熱,拆下E并稱重,E增重bg。則鐵碳合金中鐵的質量分數為________________ (寫表達式)。
(4)興趣小組使用設計的如圖實驗裝置,操作正確,且每一個反應均完全,仍然發現所測得的鐵碳合金中鐵的質量分數偏低,其主要原因是________________。
(5)若反應一段時間后,用滴管吸取A中的溶液滴入到適量水中作為試樣,試樣中所含金屬離子的成分有以下三種可能:
I:只含有Fe3+; II:只含有Fe2+;III:________________________
驗證III的實驗方法是________________________
(1)常溫下碳與濃硫酸不反應,常溫下Fe遇濃硫酸發生鈍化
(2)品紅溶液褪色,或“顏色變淺”;除盡反應產物中的SO2氣體
(3)(11m-3b)/11m
(4)干燥管中的堿石灰吸收了空氣中的二氧化碳、水蒸氣等
(5)既有Fe2+又有Fe3+
取試樣少許于試管中,先滴加少量的KSCN溶液,振蕩后溶液顯紅色證明有Fe3+;再取試樣少許于另一支試管中,滴加少量的酸性KMnO4溶液,若淺紅色褪去,證明溶液中含有Fe2+。
【解析】
試題分析:(1)常溫下,碳與濃硫酸不反應,Fe遇濃硫酸發生鈍化,因此無明顯現象。
(2)點燃酒精燈后,反應開始,碳與濃硫酸反應可生成CO2和SO2,Fe與濃硫酸反應生成SO2,B裝置檢驗SO2,現象是品紅褪色,C裝置除盡SO2,D裝置干燥氣體,E裝置吸收CO2。
(3)E增重的是CO2的質量,bgCO2中C的質量為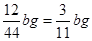 ,因此Fe的質量分數為
,因此Fe的質量分數為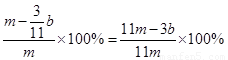 。
。
(4)該實驗的原理是通過測量CO2的量計算鐵的質量分數,CO2的質量通過干燥管E的實驗前后質量差獲得,干燥管右側直接通空氣,則空氣中的CO2、水蒸氣都可能進入干燥管中,使CO2的質量偏大,鐵的質量分數偏小。
(5)結合前兩種可能,則第三種是既有Fe2+又有Fe3+。檢驗Fe3+一般用KSCN,現象是溶液顯紅色,檢驗Fe2+一般利用其還原性,用酸性KMnO4溶液檢驗,現象是淺紅色褪去。
考點:考查實驗原理分析,裝置作用,實驗數據處理,實驗探究,離子檢驗。


科目:高中化學 來源: 題型:
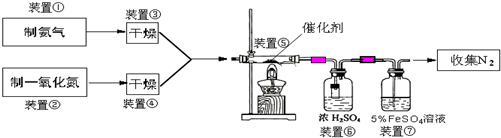
| ||
| ||

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 (2013?保定一模)某校化學興趣小組設計了如下實驗裝置(圖中部分夾持儀器已略去)來測 定某鐵碳合金中鐵的質量分數,并探究鐵與濃硫酸的反應.請回答下列問題:
(2013?保定一模)某校化學興趣小組設計了如下實驗裝置(圖中部分夾持儀器已略去)來測 定某鐵碳合金中鐵的質量分數,并探究鐵與濃硫酸的反應.請回答下列問題:| 3b |
| 11m |
| 3b |
| 11m |
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| ||
| m-c |
| m |
| m-c |
| m |
查看答案和解析>>
科目:高中化學 來源: 題型:
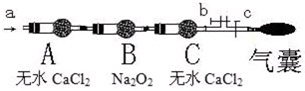
查看答案和解析>>
科目:高中化學 來源:2012-2013學年廣東佛山佛山一中高一下學期第一次段考化學試卷(帶解析) 題型:實驗題
某校化學興趣小組設計了圖示實驗裝置(圖中省略了夾持儀器)來測定某鐵碳合金中鐵的質量分數。
(1)m g鐵碳合金中加入過量濃硫酸,未點燃酒精燈前,A、B均無明顯現象,其原因是:①常溫下碳與濃硫酸不反應;②_____________。
(2)寫出加熱時A中碳與濃硫酸發生反應的化學方程式____________。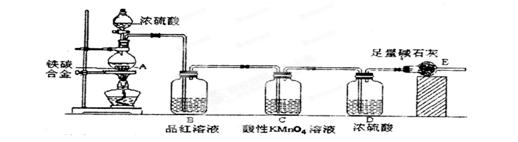
(3)B中的現象是:____________;C的作用是:_______________。
(4)待A中不再逸出氣體時,停止加熱,拆下E并稱重,E增重b g。則鐵碳合金中鐵的質量分數為_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com