
【題目】下列有機物中,既能發生水解又能發生消去反應的是( )
A.乙醇B.一溴乙烷C.乙酸乙酯D.苯
科目:高中化學 來源: 題型:
【題目】某溶液含有①NO3- ②HCO3- ③SO32- ④CO32- ⑤SO42- 等五種陰離子,向其中加入少量的過氧化鈉固體后,溶液中的離子濃度基本保持不變的是(忽略溶液體積變化)( )
A. ① B. ①⑤ C. ①④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤化工中常需研究不同溫度下平衡常數、投料比及產率等問題。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常數隨溫度的變化如下表:下列敘述正確的是
CO2(g)+H2(g)的平衡常數隨溫度的變化如下表:下列敘述正確的是
溫度/℃ | 400 | 500 | 830 | 1000 |
平衡常數K | 10 | 9 | 1 | 0.6 |
A. 該反應的正反應是吸熱反應
B. 該反應達到平衡后,保持容器休積不變升高溫度,正反應速率不變,容器內混合氣體的壓強不變
C. 830℃時,在恒容反應器中按物質的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反應混合物發生上述反應,初始時刻v正<v逆
D. 830℃時,在2L的密閉容器中加入4molCO(g)和6molH2O(g)達到平衡時,CO的轉化率是60%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放顯減少10%,二氧化碳(CO2)的排放量也要大幅減少。
(1)在恒溫,容積為1L恒容中,硫可以發生如下較化,其反應過程和能量關系如圖1所示(已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1),請回答下列問題:
2SO3(g) ΔH=-196.6 kJ·mol-1),請回答下列問題:
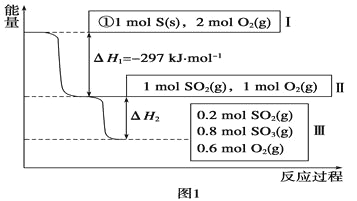
①寫出能表示硫的燃燒熱的熱化學方程式:_________。,
②ΔH2=_________kJ·mol-1。
③在相同條件下,充入1molSO3和0.5mol的O2,則達到平衡時SO3的轉化率為_______;此時該反應______(填“放出“或“吸收”)_______kJ的能量。
(2)中國政府承諾,到2020年,單位GDP二氧化碳排放比2005年下40%~50%。
①CO2可轉化成有機物實現碳循環。在休積為1L的密閉容器中,充入lmolCO2和3molH2,一定條件下反應:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,測得CO2和CH3OH(g)濃度隨時間變化如圖所示。從3min到9min,v(H2)=_______mol/(L·min)
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,測得CO2和CH3OH(g)濃度隨時間變化如圖所示。從3min到9min,v(H2)=_______mol/(L·min)
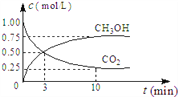
②為了加快化學反應速率且使體系中氣體的物質的量減少,其他條件不變時,可采取的措施有_______ (填編號)。
A.升高溫度 B.縮小容器體積 C.再充入CO2氣體 D.使用合適的催化劑
(3)工業上,CH3OH也可由CO2和H2合成。參考合成反應CO(g)+2H2(g) ![]() CH3OH(g)的平衡常數。下列說法正確的是______________。
CH3OH(g)的平衡常數。下列說法正確的是______________。
溫度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常數 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.該反應正反應是放熱反應
B.該反應在低溫下不能自發進行,高溫下可自發進行,說明該反應△S<0
C.在T℃時,1L密閉容器中,投入0.1molCO和0.2molH2,達到平衡時,CO轉化率為50%,則此時的平衡常數為100
D.工業上采用稍高的壓強(5MPa)和250℃,是因為此條件下,原料氣轉化率最高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖表示有關物質(均由短周期元素形成)之間的轉化關系,其中A為常見的金屬單質,B為非金屬單質(一般是黑色粉末),C是常見的無色無味液體,D是淡黃色的固體化合物。(反應條件圖中已省略。)
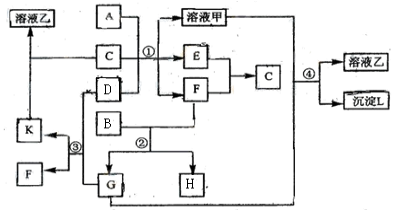
(1)A、B、C、D代表的物質分別為 、 、 、 (填化學式);
(2)反應①中的C、D均過量,該反應的化學方程式是 ;
![]() (3)反應②中,若B與F物質的量之比為4∶3,G、H分別是 、 (填化學式);
(3)反應②中,若B與F物質的量之比為4∶3,G、H分別是 、 (填化學式);
![]() (4)反應③產物中K的化學式為 ;
(4)反應③產物中K的化學式為 ;
![]() (5)反應④的離子方程式為 。
(5)反應④的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2O5是一種新型硝化劑,在一定溫度下可發生如下反應:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1溫度時,向密閉容器中通入N2O5氣體,部分實驗數據見下表:
4NO2(g) + O2(g) △H >0。T1溫度時,向密閉容器中通入N2O5氣體,部分實驗數據見下表:
時間/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列說法正確的是
A.500 s內NO2的生成速率為2.96×10-3mol·L-1·s-1
B.T1溫度下該反應平衡時N2O5的轉化率為29.6%
C.達到平衡后,其他條件不變,將容器的體積壓縮到原來的1/2,則c(N2O5)﹤5.00mol/L
D.T1溫度下的平衡常數為K1,T2溫度下的平衡常數為K2,若T1>T2,則K1>K2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com