
【題目】有A、B、C、D四種元素,其中A元素和B元素的原子都有1個未成對電子,A+比B﹣少一個電子層,B原子得一個電子后3p軌道全滿;C原子的p軌道中有3個未成對電子,其氣態氫化物在水中的溶解度在同族元素所形成的氫化物中最大;D的最高化合價和最低化合價的代數和為4,其最高價氧化物中含D的質量分數為40%,且其核內質子數等于中子數.R是由A、D兩元素形成的離子化合物,其中A與D離子數之比為2:1.請回答下列問題:
(1)A單質、B單質、化合物R的熔點大小順序為下列的(填序號)①A單質>B單質>R; ②R>A單質>B單質;
③B單質>R>A單質; ④A單質>R>B單質.
(2)在CB3分子中C元素原子的原子軌道發生的是雜化,其固體時的晶體類型為 .
(3)寫出D原子的核外電子排布式 , C的氫化物比D的氫化物在水中溶解度大得多的可能原因 .
(4)如圖是D和Fe形成的晶體FeD2最小單元“晶胞”,FeD2晶體中陰、陽離子數之比為 , FeD2物質中具有的化學鍵類型為 . 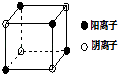
【答案】
(1)②
(2)sp3;分子晶體
(3)1s22s22p63s23p4;氨氣分子和水分子間能形成氫鍵且能發生化學反應
(4)1:1;離子鍵、共價鍵
【解析】解:A、B、C、D四種元素,B原子得一個電子后3p軌道全滿,則B是Cl元素;A+比B﹣少一個電子層,則A是Na元素;C原子的p軌道中有3個未成對電子,則為第VA族元素,其氣態氫化物在水中的溶解度在同族元素所形成的氫化物中最大,說明其氫化物中能和水形成分子間氫鍵,所以C是N元素;D的最高化合價和最低化合價的代數和為4,處于ⅥA族,其最高價氧化物中含D的質量分數為40%,且其核內質子數等于中子數,所以D是S元素;R是由A、D兩元素形成的離子化合物,其中A與D離子的數目之比為2:1,則R是Na2S.(1)A單質、B單質、化合物R分別是Na、Cl2、Na2S,硫化鈉是離子晶體,鈉是金屬晶體,固體氯氣是分子晶體,金屬Na的熔點很低,故晶體熔點高低順序是:R>A單質>B單質,故選②;(2)NCl3分子中氮原子含有3個共價單鍵且含有一個孤電子對,N原子采取sp3雜化,其固態時的晶體中構成微粒是分子,所以晶體類型為分子晶體,所以答案是:sp3;分子晶體;(3)D是S元素,原子的核外電子排布式1s22s22p63s23p4 , C的氫化物是NH3 , D的氫化物是H2S,氨氣分子和水分子間能形成氫鍵且能發生化學反應,導致氨氣溶解性大于硫化氫,所以答案是:1s22s22p63s23p4;氨氣分子和水分子間能形成氫鍵且能發生化學反應;(4)FeS2晶體中陰離子數目為4× ![]() =
= ![]() 、陽離子數目為4×
、陽離子數目為4× ![]() =
= ![]() ,故陰離子、陽離子數之比為1:1,FeS2物質中含有離子鍵,S22﹣含有共價鍵,所以答案是:1:1;離子鍵、共價鍵.
,故陰離子、陽離子數之比為1:1,FeS2物質中含有離子鍵,S22﹣含有共價鍵,所以答案是:1:1;離子鍵、共價鍵.


 新課標階梯閱讀訓練系列答案
新課標階梯閱讀訓練系列答案 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:
【題目】有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的濃度為2mol·L-1,含硝酸的濃度為
1mol·L-1,現向其中加入0.96g銅粉,充分反應后(假設只生成NO氣體),最多可收集到
標準狀況下的氣體的體積為
A. 89.6mL B. 112mL
C. 168mL D. 224mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用反應2Cu+O2+2H2SO4![]() 2CuSO4+2H2O可制備CuSO4,若將該反應設計為原電池。
2CuSO4+2H2O可制備CuSO4,若將該反應設計為原電池。
(1)負極材料是________(寫名稱),電極反應式為_____________________________________。
(2)正極電極反應式為___________________________________________________________。
(3)溶液中![]() 向________極移動。
向________極移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的Mg-Al合金投入100mL一定物質的量濃度的某HCl溶液中,充分反應。向反應后的溶液中逐滴加入一定物質的量濃度的NaOH溶液,生成沉淀的質量與所加NaOH溶液的體積關系如下圖。回答下列問題:
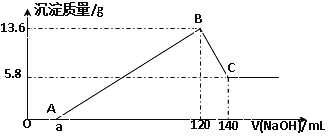
(1)寫出OA段和BC段反應的離子方程式:
OA:________________________________ ; BC:_____________________________;
(2)原Mg-Al合金的質量是_____________。
(3)原HCl溶液的物質的量濃度是________________。
(4)所加NaOH溶液的物質的量濃度是____________。
(5)a的值是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素W、X、Y、Z的原子序數依次增大,W與Y最外層電子數之和為X的最外層電子數的2倍,Z最外層電子數等于最內層電了數,X、Y、Z的簡單離子的電子層結構相同,W的單質是空氣中體積分數最大的氣體。下列說法正確的是
A. Y的最高價氧化物對成水化物的酸性比W的強
B. W的氣態氫化物比X的穩定
C. 離子半徑的大小順序:r(w)>r(X)>r(Y)>(Z)
D. XY2與ZY2中的化學鍵類型相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO、CO2是火力發電廠釋放出的主要尾氣,為減少對環境造成的影響,發電廠試圖采用以下方法將其資源化利用,重新獲得燃料或重要工業產品。
(1)CO 與Cl2在催化劑的作用下合成光氣(COCl2)。某溫度下,向2L的密閉容器中投入一定量的CO和Cl2,在催化劑的作用下發生反應:CO(g)+Cl2(g)![]() COCl2(g) ;△H=akJ/mol 反應過程中測定的部分數據如下表:
COCl2(g) ;△H=akJ/mol 反應過程中測定的部分數據如下表:
t/min | n (CO) /mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反應1~2min末的平均速率v(COCl2)=________mol/(L·min)。
②在2min~4min間,vCl2正_______vCO逆 (填“>”、“=”或“<”),該溫度下K=________。
③已知X、L可分別代表溫度或壓強,下圖表示L一定時,CO的轉化率隨X的變化關系。
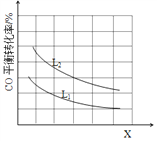
X代表的物理量是___________;a_______0 (填“>”,“=”,“<”)。
(2)在催化劑作用下NO和CO轉化為無毒氣體:2CO(g) +2NO(g)![]() 2CO2(g) +N2(g);△H=-748kJ·mol-1
2CO2(g) +N2(g);△H=-748kJ·mol-1
①一定條件下,單位時間內不同溫度下測定的氮氧化物轉化率如圖1所示。溫度高于710K時,隨溫度的升高氮氧化物轉化率降低的原因可能是________________________________________________。
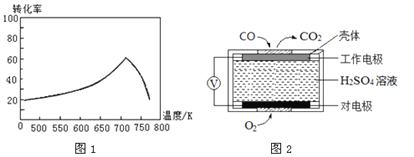
②已知: 測定空氣中NO和CO含量常用的方法有兩種:
方法1:電化學氣敏傳感器法。其中CO 傳感器的工作原理如圖2 所示,則工作電極的反應式為____________。
方法2:氧化還原滴定法。用H2O2溶液吸收尾氣、將氮氧化物轉化為強酸,用酸堿中和滴定法測定強酸依度。寫出NO與H2O2溶液反應的離子方程式:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物E和F可用作塑料增塑劑或涂料中的溶劑,它們的分子量相等,可用以下方法合成:
(1)請寫出:有機物的名稱:A , B
(2)化學方程式:A+D→E , B+G→F .
(3)X反應的類型及條件:類型 , 條件 .
(4)E和F的相互關系屬(多選扣分).
①同系物 ②同分異構體 ③同一種物質 ④同一類物質.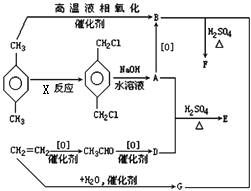
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com