
【題目】(1)維生素C又稱為抗壞血酸,在人體內(nèi)有重要的功能。例如,幫助人體將食物中攝取的不易吸收的Fe3+變?yōu)橐孜盏腇e2+。這說明維生素C具有________(填“氧化性”或“還原性”)。
(2)2Na+O2![]() Na2O2反應中,
Na2O2反應中,
①________被氧化,________是氧化劑,氧化產(chǎn)物是_______,過氧化鈉中氧元素的化合價是_______。
②此反應中若轉(zhuǎn)移了2 mol的電子,則需要氧氣________ mol。
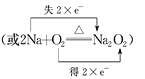
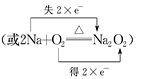
③用單線橋或雙線橋法表示反應中電子轉(zhuǎn)移的方向和數(shù)目:______________________。
(3)根據(jù)反應①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判斷下列物質(zhì)的氧化性由強到弱的順序中,正確的是____________。
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
【答案】還原性NaO2 Na2O211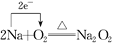
 D
D
【解析】
(1)Fe元素的化合價降低,則維生素C中某元素的化合價升高,說明維生素C具有還原性;
(2)①2Na+O2![]() Na2O2反應中,Na元素的化合價升高,被氧化,Na2O2為氧化產(chǎn)物,O元素的化合價降低,則O2為氧化劑,過氧化鈉中氧元素的化合價是-1價;
Na2O2反應中,Na元素的化合價升高,被氧化,Na2O2為氧化產(chǎn)物,O元素的化合價降低,則O2為氧化劑,過氧化鈉中氧元素的化合價是-1價;
②由反應可以知道,該反應轉(zhuǎn)移2e-,若轉(zhuǎn)移了2mol的電子,則需要氧氣1mol;
(3) 2Na+O2![]() Na2O2反應中,Na元素的化合價升高,失去的電子數(shù)為2,O元素得到的電子數(shù)為2,則雙線橋法表示反應電子轉(zhuǎn)移的方向和數(shù)目為
Na2O2反應中,Na元素的化合價升高,失去的電子數(shù)為2,O元素得到的電子數(shù)為2,則雙線橋法表示反應電子轉(zhuǎn)移的方向和數(shù)目為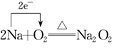
 ;
;
(3) ①2FeCl3+2KI=2FeCl2+2KCl+I2,氧化性順序是Fe3+>I2;②2FeCl2+Cl2=2FeCl3,氧化性順序是Cl2>Fe3+,所以氧化性順序是Cl2>Fe3+>I2。故選D。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】已知BaCO3、BaSO4溶度積常數(shù)分別為Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,則BaSO4可做鋇餐,BaCO3不能作鋇餐的主要理由是( )
A. BaSO4的溶度積常數(shù)比BaCO3的小
B. SO![]() 沒有毒性,CO
沒有毒性,CO![]() 有毒性
有毒性
C. BaSO4的密度大
D. 胃酸能與CO![]() 結(jié)合,生成CO2和H2O,使BaCO3的溶解平衡向右移動,Ba2+濃度增大,造成人體Ba2+中毒
結(jié)合,生成CO2和H2O,使BaCO3的溶解平衡向右移動,Ba2+濃度增大,造成人體Ba2+中毒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業(yè)上利用軟錳礦漿煙氣脫硫吸收液制取電解錳,并利用陽極液制備高純碳酸錳、回收硫酸銨的工藝流程如下(軟錳礦的主要成分是MnO2,還含有硅、鐵、鋁的氧化物等雜質(zhì)):
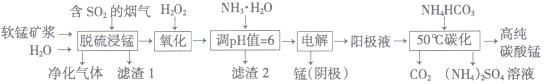
已知:Fe(OH)3的Ksp=l.0×10-38,Al(OH)3的Ksp=1.0×10-34
(1)一定溫度下, “脫硫浸錳”主要產(chǎn)物為MnSO4,生成該產(chǎn)物的化學方程式為_________。
(2)常溫下,調(diào)節(jié)pH=6時,得到的“濾渣2”主要成分為Fe(OH)3和_____(化學式),此時溶液中的Fe3+物質(zhì)的量濃度為_________ 。
(3)“電解”時用惰性電極,陽極的電極反應式為_______________。
(4)“50℃碳化”得到高純碳酸錳,反應的離子方程武為____________________。“50℃碳化”時加入過量NH4HCO3,可能的原因:①使MnSO4充分轉(zhuǎn)化為MnCO3;②________________;③________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應是一類重要的反應,請按要求完成下列題目。
(1)對反應NH3+O2——NO+H2O(未配平)作分析,并用單線橋法標出電子轉(zhuǎn)移的方向和數(shù)目:_____________。該反應中,________是還原劑,________是還原產(chǎn)物,被還原的物質(zhì)是________。
(2)在一定條件下,反應2NH3+3CuO![]() 3Cu+N2+3H2O能順利進行,對此反應的分析合理的是________。
3Cu+N2+3H2O能順利進行,對此反應的分析合理的是________。
①該反應是置換反應
②反應中NH3被氧化為N2
③在反應中體現(xiàn)了金屬銅的還原性
④在反應中每生成1 mol H2O轉(zhuǎn)移1 mol電子
(3)在反應2H2S+SO2![]() 3S+2H2O中被氧化的元素與被還原的元素的質(zhì)量比為 ________。
3S+2H2O中被氧化的元素與被還原的元素的質(zhì)量比為 ________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】TiO2和TiCl4均為重要的工業(yè)原料。已知:
Ⅰ.TiCl4(g)+O2(g)![]() TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1
TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1
Ⅱ.2C(s)+O2(g)![]() 2CO(g) ΔH2= -220.9kJ·mol-1
2CO(g) ΔH2= -220.9kJ·mol-1
請回答下列問題:
(1)TiCl4(g)與CO(g)反應生成TiO2(s)、C(s)和氯氣的熱化學方程式為_____________________。升高溫度,對該反應的影響為___________________________________。
(2)若反應Ⅱ的逆反應活化能表示為EkJ·mol-1,則E________220.9(填“>”“<”或“=”)。
(3)t℃時,向10 L恒容密閉容器中充入1molTiCl4和2 molO2,發(fā)生反應Ⅰ。5min達到平衡時測得TiO2的物質(zhì)的量為0.2 mol。
①0~5 min 內(nèi),用Cl2表示的反應速率v(Cl2)=__________。
②TiCl4的平衡轉(zhuǎn)化率a=__________________。
③下列措施,既能加快逆反應速率又能增大TiCl4的平衡轉(zhuǎn)化率的是__________(填選項字母)。
A.縮小容器容積 B.加入催化劑 C.分離出部分TiO2 D.增大O2濃度
④t℃時,向10 L恒容密閉容器中充入3 mol TiCl4和一定量O2的混合氣體,發(fā)生反應Ⅰ,兩種氣體的平衡轉(zhuǎn)化率(a)與起始的物質(zhì)的量之比(![]() )的關(guān)系如圖所示:
)的關(guān)系如圖所示:
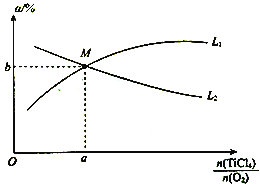
能表示TiCl4平衡轉(zhuǎn)化率的曲線為__________(填“L1”或“L2”);M點的坐標為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下鐵可以和CO2發(fā)生反應:Fe(s)+CO2(g) ![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,反應過程中CO2氣體和CO氣體的濃度與時間的關(guān)系如右圖所示,則8分鐘內(nèi)CO的平均反應速率v(CO)=______。

(2)寫出該反應平衡常表達式:K=__________;下列措施中能使該反應的平衡常數(shù)K增大的是____(填序號)。
A.升高溫度 B.增大壓強 C.充入CO D.再加入一些鐵粉
(3)反應達到平衡后,若保持容器體積不變時,再通入少量的CO2,則CO2的轉(zhuǎn)化率將______ (填“增大”、“減小”、“不變”)。
(4)鐵的重要化合物在生產(chǎn)生活中應用十分廣泛。
①高鐵酸鈉(Na2FeO4)是一種新型飲用水消毒劑。高鐵酸鈉生產(chǎn)方法之一是:強堿性溶液中用NaClO氧化Fe(OH)3生成高鐵酸鈉、氯化鈉和另一種常見化合物,該反應的離子方程式為____________。
②高鐵電池的總反應為:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列敘述錯誤的是____(填序號)。
A.放電時每轉(zhuǎn)移6mol電子,負極有2mol K2FeO4被還原
B.充電時陰極反應為:Zn(OH)2 +2e-=Zn+ 2OH-
C.放電時正極反應為:FeO42-+ 3e-+ 4H2O= Fe(OH)3+ 5OH-
D.充電時陽極附近溶液的堿性減弱
(5)已知:2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ/mol
2H2(g)+ O2(g)= 2H2O(g);△H=-483.6 kJ/mol
寫出CO和H2O(g)作用生成CO2和H2的熱化學方程式:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 將稀氨水逐滴加入稀硫酸中,當溶液pH=7時,c(SO42-)>c(NH4+)
B. 兩種醋酸溶液的物質(zhì)的量濃度分別為c1和c2,pH分別為a和a+1,則c1=l0c2
C. pH =11的NaOH溶液與pH=3的醋酸溶液等體積混合,滴入石蕊溶液呈紅色
D. NaHCO3溶液中有:HCO3-+H2O![]() CO32-+H3O+加水稀釋后,H+濃度減小
CO32-+H3O+加水稀釋后,H+濃度減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2014年5月7日,天津某工程檢測公司在進行探傷作業(yè)期間,一枚黃豆粒大小的放射源銥-192丟失,造成了嚴重的安全事故,圖示是銥在元素周期表中的信息,下列說法正確的是( )
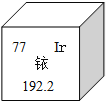
A. 銥的相對原子質(zhì)量為192.2克
B. 銥原子核內(nèi)的中子數(shù)為77
C. K2IrO3中Ir的化合價為+4
D. 生活中常用的銥金筆為純凈的銥單質(zhì)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理知識研究如何利用CO、SO2等污染物有重要意義。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
則CO(g)+2H2(g) ![]() CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能夠增大上述合成甲醇反應的反應速率的是________(填寫序號).
a.使用高效催化劑 b.降低反應溫度
c.增大體系壓強 d.不斷將CH3OH從反應混合物中分離出來
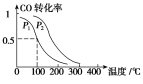
(3)在一定壓強下,容積為V L的容器中充入a mol CO與2a mol H2,在催化劑作用下反應生成甲醇,平衡轉(zhuǎn)化率與溫度、壓強的關(guān)系如右圖所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃時,該反應的化學平衡常數(shù)K=________(mol·L-1)-2;
③在其它條件不變的情況下,再增加a mol CO和2a molH2,達到新平衡時,CO的轉(zhuǎn)化率________(填“增大”、“減小”或“不變”)。
(4)某科研小組用SO2為原料制取硫酸。
①利用原電池原理,用SO2、O2和H2O來制備硫酸,該電池用多孔材料作電極,它能吸附氣體,同時也能使氣體與電解質(zhì)溶液充分接觸。請寫出該電池的負極的電極反應式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后電解該溶液可制得硫酸。電解原理示意圖如下圖所示。請寫出開始時陽極反應的電極反應式________________。
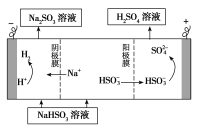
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com