
苯乙烯是現代石油化工產品中最重要的單體之一。在工業上,苯乙烯可由乙苯和CO2
催化脫氫制得。總反應原理如下: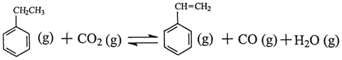 △H
△H
回答下列問題:
(1)乙苯在CO2氣氛中的反應可分兩步進行: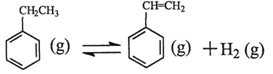 △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1
H2 (g)+CO2 (g) CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1
由乙苯制取苯乙烯反應的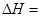 。
。
(2)在溫度為T1時,該反應的平衡常數K=0.5mol/L。在2L的密閉容器中加入乙苯與CO2,反應到某時刻測得混合物中各組分的物質的量均為1.0mol。
①該時刻化學反應 (填“是”或“不是”)處于平衡狀態;
②下列敘述能說明乙苯與CO2在該條件下反應已達到平衡狀態的是 (填正確答案編號);
a.正、逆反應速率的比值恒定 b.c(CO2)=c(CO)
c.混合氣體的密度不變 d.CO2的體積分數保持不變
③若將反應改為恒壓絕熱條件下進行,達到平衡時,則乙苯的物質的量濃度 (填正確答案編號)
| A.大于0.5mol/L | B.小于0.5mol/L |
| C.等于0.5mol/L | D.不確定 |
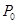 ,則反應達到平衡時苯乙烯的濃度為 , (均用含
,則反應達到平衡時苯乙烯的濃度為 , (均用含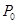 、P的表達式表示)。
、P的表達式表示)。(1)+158.8kJ·mol-1(2分)(2)①是(2分) ②abd (3分) ③d(2分)
(3)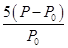 mol·L-1 (2分)
mol·L-1 (2分) 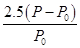 ×100%(2分)
×100%(2分)
(4)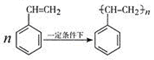 (2分)
(2分)
解析試題分析:(1)根據蓋斯定律,兩個方程式合并就得到乙苯制取苯乙烯反應的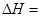 +158.8kJ·mol-1。
+158.8kJ·mol-1。
(2)①在2L的密閉容器中加入乙苯與CO2,反應到某時刻測得混合物中各組分的物質的量均為1.0mol,所以各組分的濃度都是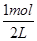 =0.5mol·L-1,QC=
=0.5mol·L-1,QC=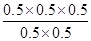 =0.5=K,所以該時刻化學反應是處于平衡狀態;
=0.5=K,所以該時刻化學反應是處于平衡狀態;
②ad兩個選項都容易看出可以作為標志,要注意的是b,c(CO2)=c(CO)代表各組分的濃度相等,實際上就是①的情況,所以也可以說明是達到了平衡狀態。c錯,因為該反應實在在2L的密閉容器中加入乙苯與CO2,所以體積不變,根據質量守恒,氣體的質量也不變,所以密度是一個定制,不能作為達到平衡的標志,所以c不能選。
③因為該反應前后系數不等,恒壓就要擴大體積,平衡向正向移動,因為該反應正向是吸熱反應,絕熱要向逆向移動,所以恒壓絕熱兩個因素都在變化,不確定向哪個方向移動,所以乙苯的物質的量濃度不能確定。
(3)三段法
起始濃度 2.0 3.0 0 0 0
轉化濃度 x x x x x
平衡濃度 2.0-x 3.0-x x x x  =
=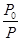
反應達到平衡時苯乙烯的濃度為x=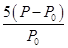 mol·L-1
mol·L-1
乙苯的轉化率為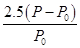 ×100%
×100%
(4)根據雙鍵的性質,加聚反應的規律即可寫出 。
。
考點:考查化學反應原理的知識。


 小博士期末闖關100分系列答案
小博士期末闖關100分系列答案 名校名師培優作業本加核心試卷系列答案
名校名師培優作業本加核心試卷系列答案科目:高中化學 來源: 題型:填空題
甲醇是一種可再生能源,具有廣泛的開發和應用前景。
(1)工業上一般采用下列兩種反應合成甲醇:
反應Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反應Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反應符合“原子經濟”原則的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列數據是反應Ⅰ在不同溫度下的化學平衡常數(K)。
| 溫度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
據《遼沈晚報》報道,今年冬天,一旦出現大氣嚴重污染的天氣,沈陽市有可能建議政府機關、企事業單位根據實際情況實行員工休假或彈性工作制。大氣含有的CO、氮氧化物、SO2、煙塵等污染是導致霧霾天氣的原因之一,化學反應原理是減少和控制霧霾天氣的理論依據。
(1)CO2經常用氫氧化鈉來吸收,現有0.4molCO2,若用200ml 3mol/LNaOH溶液將其完全吸收,溶液中離子濃度由大到小的順序為:
(2) CO可制做燃料電池,以KOH溶液作電解質,向兩極分別充入CO和空氣,工作過程中,,負極反應方程式為:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常溫下將SO2轉化為SO42-,從而實現對SO2的處理(總反應為2SO2+O2+2H2O=2H2SO4)。已知,含SO2的廢氣通入含Fe2+、Fe3+的溶液時,其中一個反應的離子方程式為4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,則另一反應的離子方程式為 ;
(4)CO2在自然界循環時可與CaCO3反應,CaCO3是一種難溶物質,其Ksp=2.8×10—9。CaCl2溶液與Na2CO3溶液混合可形成CaCO3沉淀,現將等體積的CaCl2溶液與Na2CO3溶液混合,若Na2CO3溶液的濃度為2×10—4mo1/L ,則生成沉淀所需CaCl2溶液的最小濃度為 。
(5)已知在常溫常壓下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)?△H=" -44.0" kJ·mol-1
寫出體現甲醇燃燒熱的熱化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
研究CO2的利用對促進低碳社會的構建具有重要的意義。
(1)將CO2與焦炭作用生成CO,CO可用于煉鐵等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
則CO還原Fe2O3的熱化學方程式為________________________________
(2)某實驗將CO2和H2充入一定體積的密閉容器中,在兩種不同條件下發生反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,測得CH3OH的物質的量隨時間的變化如圖所示,請回答下列問題:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,測得CH3OH的物質的量隨時間的變化如圖所示,請回答下列問題: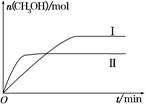
①該反應的平衡常數的表達式為K=________。
②曲線Ⅰ、Ⅱ對應的平衡常數大小關系為KⅠ________KⅡ(填“大于”、“等于”或“小于”)。
③在下圖a、b、c三點中,H2的轉化率由高到低的順序是________(填字母)。
(3)在其他條件不變的情況下,將容器體積壓縮到原來的1/2,與原平衡相比,下列有關說法正確的是________(填序號)。
a.氫氣的濃度減小
b.正反應速率加快,逆反應速率也加快
c.甲醇的物質的量增加
d.重新平衡時n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)由磷灰石[主要成分Ca5(PO4)3F]在高溫下制備黃磷(P4)的熱化學方程式為:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反應中,副產物礦渣可用來________。
②已知相同條件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江蘇)用H2O2和H2SO4的混合溶液可溶出印刷電路板金屬粉末中的銅。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)ΔH1=+64.39 kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196.46 kJ·mol-1
③H2(g)+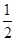 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu與H2O2反應生成Cu2+和H2O的熱化學方程式為_________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
“低碳循環”已引起各國家的高度重視,而如何降低大氣中CO2的含量和有效地開發利用CO2正成為化學家研究的主要課題。
(1)將不同量的CO(g)和H2O(g)分別通入到體積為2L的恒容密閉容器中,進行反應
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三組數據:
CO2(g)+H2(g),得到如下三組數據:
| 實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡所需 時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氮元素的氫化物和氧化物在工業生產和國防建設中都有廣泛應用,回答下列問題:
(1)氮元素原子的L層電子數為________;
(2)肼可作為火箭發動機的燃料,與氧化劑N2O4反應生成N2和水蒸氣。
已知:①N2(g)+2O2(g)=N2O4(l)
ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)
ΔH2=-534.2 kJ·mol-1
寫出肼和N2O4反應的熱化學方程式________________________;
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,則表示肼燃燒熱的熱化學方程式為________________________。
(4)肼—空氣燃料電池是一種堿性電池,該電池放電時,負極的反應式為________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氮是地球上含量豐富的—種元素,氮及其化合物在工農業生產、生活中有著重要作用,
減少N 的氧化物在大氣中的排放是環境保護的重要內容之一。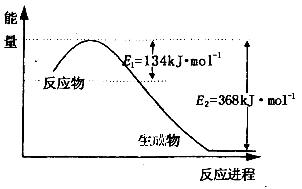
(1)上圖是1molNO2和1mol CO反應生成CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式________________________________________;
又知:N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol,則反應2NO(g)+2CO(g) N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
(2)一定溫度下,在2L密閉容器中NO2和O2可發生下列反應:4NO2(g) + O2(g) 2N2O5(g)。已知體系中n(NO2)隨時間變化加下表:
2N2O5(g)。已知體系中n(NO2)隨時間變化加下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com