
【題目】鈦呈銀白色,因它堅硬、強度大、耐熱、密度小,被稱為高技術金屬。目前生產鈦采用氯化法,即將金紅石或鈦鐵礦與焦炭混合,通入氯氣并加熱制得TiCl4:2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO。將TiCl4蒸餾并提純,在氬氣保護下與鎂共熱得到鈦:TiCl4+2Mg
TiCl4+2CO。將TiCl4蒸餾并提純,在氬氣保護下與鎂共熱得到鈦:TiCl4+2Mg![]() Ti+2MgCl2,MgCl2和過量Mg用稀鹽酸溶解后得海綿狀鈦,再在真空熔化鑄成鈦錠。請回答下列問題:
Ti+2MgCl2,MgCl2和過量Mg用稀鹽酸溶解后得海綿狀鈦,再在真空熔化鑄成鈦錠。請回答下列問題:
(1)基態鈦原子的價電子排布式為_______________________________。
(2)與CO互為等電子體的離子為_____(填化學式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp雜化的分子有__________ 。
(4)TiCl4在常溫下是無色液體,在水或潮濕空氣中易水解而冒白煙。則TiCl4屬于______(填“原子”、“分子”或“離子”)晶體。
(5)與鈦同周期的另一種元素鈷(Co)可形成分子式均為Co(NH3)5BrSO4的兩種配合物,其中一種化學式為[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液時,現象是_____________;往另一種配合物的溶液中加入BaCl2溶液時,無明顯現象,若加入AgNO3溶液時,產生淡黃色沉淀,則第二種配合物的化學式為 __________。
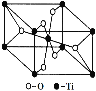
(6)在自然界中TiO2有金紅石、板鈦礦、銳鈦礦三種晶型,其中金紅石的晶胞如右圖所示,則其中Ti4+的配位數為__________。
【答案】3d24s2CN-(或NO+、C22-)CO2分子產生白色沉淀[Co (NH3)5SO4]Br6
【解析】
(1)根據構造原理,由原子序數即可寫出基態原子的電子排布式,進而可寫出價電子排布式;
(2)根據等電子體的概念寫出符合題目要求的等電子體;
(3)可根據分子的構型來判斷碳的雜化方式,四面體形屬于sp3雜化,平面形中的碳屬于sp2雜化,直線形中的碳屬于sp雜化;
(4)根據題目中提供的物理性質來判斷晶體類型;
(5)絡合物由內界和外界組成,絡合物溶于水發生電離生成內界離子(絡離子)和外界離子,與BaCl2或AgNO3溶液反應的離子肯定為外界離子,由此可判斷絡合物的組成;
(6)觀察晶胞,數數Ti周圍距離最近的O的個數即為Ti的配位數。
(1)鈦為22號元素,基態電子排布式為:[Ar]3d24s2,則基態鈦原子的價電子排布式為3d24s2,因此,本題正確答案是:3d24s2;
(2)CO為雙原子分子,價電子總數為10,則CO的等電子體為離子的為:CN-(或NO+、C22-),因此,本題正確答案是:CN-(或NO+、C22-);
(3)在CH2Cl2、C6H6、CO2、C2H4中,分子構型分別為四面體形、平面三角形、直線形、平面形,所以碳原子的雜化方式分別為sp3、sp2、sp、sp2雜化,采取sp2雜化的分子有C6H6、C2H4,所以sp雜化的是CO2,因此,本題正確答案是:CO2;
(4)因TiCl4在常溫下是無色液體,說明熔點低,在水或潮濕空氣中易水解而冒白煙,說明鈦離子為弱堿陽離子,由此可判斷TiCl4是由共價鍵結合的分子,晶體類型屬于分子晶體,
因此,本題正確答案是:分子;
(5)由[Co(NH3)5Br]SO4可以知道,硫酸根離子為配合物的外界,在水溶液中以離子形式存在,所以會與鋇離子結合成白色沉淀。加入BaCl2溶液時,無明顯現象,說明硫酸根離子在內界,若加入AgNO3溶液時,產生淡黃色沉淀,說明溴離子在外界,因此另一配合物的化學式為[Co (NH3)5SO4]Br,
因此,本題正確答案是:產生白色沉淀;[Co (NH3)5SO4]Br;
(6)觀察晶胞結構,可以知道每個鈦周圍距離最近的氧原子有6個,即鈦的配位數為6,
因此,本題正確答案是:6。


科目:高中化學 來源: 題型:
【題目】氫能被視為21世紀最具發展潛力的清潔能源,其開發利用是科學家們研究的重要課題。試回答下列問題:
(1)與化石燃料相比,氫氣作為燃料的優點是_________(至少答出兩點)。
(2)與氫氣直接燃燒相比較,設計成鎳氫電池可以大大提高能量的轉換率,在鎳氫電池充電過程中儲氫合金(M)吸氫轉化為MH2,總反應為:xNi(OH)2+M![]() xNiOOH+MHx,試寫出放電過程中負極
xNiOOH+MHx,試寫出放電過程中負極
反應式____________。
(3)施萊辛(Sehlesinger)等人提出可用NaBH4與水反應制氫氣:BH4-+2H2O=BO2-+4H2↑,已知NaBH4與水反應后所得溶液顯堿性,溶液中各離子濃度大小關系為__________,用離子方程式表示出溶液顯堿性的原因_______________。
(4)在容積均為VL的Ⅰ、Ⅱ、Ⅲ三個相同密閉容器中,分別放入ag的儲氫合金(M)和bmol氫氣發生如下反應:2M(s)+xH2(g)![]() 2MHx(s) ΔH<0,三個容器的反應溫度分別為T1、T2、T3且恒定不變,在其他條件相同的情況下,實驗測得反應均進行到1min時M的質量如圖1所示,此時Ⅰ、Ⅱ、Ⅲ三個容器中一定達到化學平衡狀態的是___________,當三個容器反應都達到化學平衡時,H2轉化率最大的反應溫度是______。
2MHx(s) ΔH<0,三個容器的反應溫度分別為T1、T2、T3且恒定不變,在其他條件相同的情況下,實驗測得反應均進行到1min時M的質量如圖1所示,此時Ⅰ、Ⅱ、Ⅲ三個容器中一定達到化學平衡狀態的是___________,當三個容器反應都達到化學平衡時,H2轉化率最大的反應溫度是______。

(5)儲氫還可以借助有機物,如利用乙苯與苯乙烯之間的可逆反應來實現脫氫和加氫;

①在恒容密閉容器中,控制不同溫度進行乙苯的脫氫實驗。以乙苯起始濃度均為c mol/L測定乙苯的轉化率,結果如圖2所示。圖中A為乙苯的平衡轉化率與溫度關系曲線,B曲線表示不同溫度下反應經過相同時間且為達到化學平衡時乙苯的轉化率。試說明隨溫度的升高,曲線B向曲線A逼近的原因__________。
②維持體系總壓恒定,在溫度T時,物質的量為n、體積為V的乙苯蒸氣發生催化脫氫。已知乙苯的平衡轉換率為a,則在該溫度下反應的平衡常數K=__________(用a等符號表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關氧化還原反應的敘述中,正確的是( )
A.一定有氧元素參加B.氧化劑本身發生氧化反應
C.一定有電子轉移(得失或偏移)D.氧化反應一定先于還原反應發生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨催化氧化是硝酸工業的基礎,在某催化劑作用下只發生主反應①和副反應②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列說法正確的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列說法正確的是

A. 工業上進行氨催化氧化生成NO時,溫度應控制在780~840℃之間
B. 工業上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是為了提高反應速率
C. 在加壓條件下生產能力可提高5~6倍,是因為加壓可提高轉化率
D. 氮氣氧化為NO的熱化學方程式為:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是

A. 圖甲可以判斷出反應A(g) + B(g)![]() 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1
B. 圖乙表示壓強對可逆反應2A(g) + 2B(g)![]() 3C(g) + D(s)的影響,乙的壓強比甲的壓強大
3C(g) + D(s)的影響,乙的壓強比甲的壓強大
C. 據圖丙,若除去CuSO4溶液中的Fe3+可向溶液中加入適量CuO至pH≈4
D. 圖丁表示25℃時,用0.1 mol·L—1鹽酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH隨加入鹽酸體積的變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若圖①表示向含Mg2+、Al3+、NH4+的鹽溶液中滴加NaOH溶液時,沉淀的量與NaOH的體積的關系圖。

下列各表述與示意圖一致的是
A. 圖①三種離子的物質的量之比為:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 圖①中使用的NaOH的濃度為2mol/L
C. 圖②中物質A反應生成物質C,△H>0
D. 圖②中曲線表示某反應過程的能量變化。 若使用催化劑,B點會降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學的進步離不開技術的突破。原子光譜核磁共振、X射線行射、量子計算等技術的發展與應用都推進了結構的研究。如過渡元素原子結構、超分子結構、晶體結構、配合物結構研究等。
(1)過渡元素Cr原子的基態電子排布式為______,Cr的核外電子由激發態躍遷至基態時產生的光譜是______ (填“吸收”或“發射”)光譜。
(2)胍鎓離子[C(NH2)3+]可以與甲基磺酸根(CH3SO3-)形成超分子晶體,其局部結構如圖所示。

①組成該晶體的元素中電負性最大的是______,其中S的雜化類型有_______。
②元素C、N、S的簡單氫化物在水中的溶解度從小到大的順序為______,原因是______。
(3)①將氨氣通入CuSO4溶液中,產生藍色沉淀,繼續通過量氨氣,沉淀溶解,得到藍色透明溶液。該過程中微粒的變化是[Cu(H2O)4]2+→Cu(OH)2→[Cu(NH3)4]2+。[Cu(H2O)4]2+和[Cu(NH3)4]2+中共同含有的化學鍵類型有_________。
②已知:AlF63+在溶液中可穩定存在,CaF2難溶于水,但可溶于含Al3+的溶液中,原因是_____(用離子方程式表示)。
(4)近年研究人員通過量子化學計算預測并合成了化合物Na2He,經X射線行射分析其晶胞結構如圖所示。

①晶胞中Na堆積形成___________(填形狀)空間結構,He占據一半空隙,另一半由e-占據。已知Na2He晶體不能導電,理由是__________。
②已知晶胞邊長為anm,晶胞中Na的半徑為bnm,則He的半徑為_____nm(列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應Zn+H2SO4===ZnSO4+H2↑,下列敘述不正確的是

A. 反應過程中能量關系可用上圖表示
B. 若將該反應設計成原電池,鋅為負極,碳為正極,稀硫酸溶液做電解質
C. 若設計為原電池,當有32.5 g鋅溶解,負極放出11.2 L氣體(標準狀況下)
D. 若設計為原電池,負極有電流流入
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素①~⑧在元素周期表中的位置如下,回答有關問題:

(1)寫出⑦元素名稱_________,表中能形成兩性氫氧化物的元素是__________(填元素符號)。
(2)畫出⑥的離子結構示意圖___________,寫出②含有10個中子的核素的化學符號_________。
(3)由②④⑥三種元素組成的一種鹽在空氣中放置會變質,請用化學方程式表示變質的反應_________________________________。
(4)①②⑥⑧四種元素能組成多種鹽(每種鹽中都只含有這四種元素),寫出其中兩種鹽溶液能發生反應的離子方程式_________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com