
【題目】以磷石膏(主要成分CaSO4,雜質SiO2、Al2O3等)為原料可制備輕質CaCO3,流程圖如下。
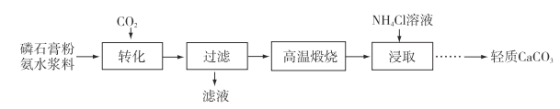
(1)勻速向漿料中通入CO2,漿料清液的pH和c(SO42-)隨時間變化見如下圖。清液pH>11時CaSO4轉化的離子方程式為________;能提高其轉化速率的措施有________(填序號)。

A.攪拌漿料
B.加熱漿料至100 ℃
C.增大氨水濃度
D.減小CO2通入速率
(2)當清液pH接近6.5時,過濾并洗滌固體。濾液中物質的量濃度最大的兩種陰離子為________和__________(填化學式);檢驗洗滌是否完全的方法是_____________________。
(3)在敞口容器中,用NH4Cl溶液浸取高溫煅燒的固體,隨著浸取液溫度上升,溶液中c(Ca2+)增大的原因是__________________________________。
【答案】(1)CaSO4+2NH3·H2O+CO2===CaCO3+2NH![]() +SO
+SO![]() +H2O
+H2O
或CaSO4+CO![]() ===CaCO3+SO
===CaCO3+SO![]() AC
AC
(2)SO![]() HCO
HCO![]() 取少量最后一次的洗滌過濾液于試管中,向其中滴加鹽酸酸化的BaCl2 溶液,若不產生白色沉淀,則表明已洗滌完全
取少量最后一次的洗滌過濾液于試管中,向其中滴加鹽酸酸化的BaCl2 溶液,若不產生白色沉淀,則表明已洗滌完全
(3)浸取液溫度上升,溶液中c(H+)增大,促進固體中Ca2+浸出
【解析】(1)向磷石膏粉、氨水漿料中通入CO2,CO2與NH3·H2O 發生反應:CO2+2NH3·H2O===2NH![]() +CO
+CO![]() +H2O,CO
+H2O,CO![]() 濃度增大,促進了CaSO4沉淀的轉化:CaSO4+CO
濃度增大,促進了CaSO4沉淀的轉化:CaSO4+CO![]() ===CaCO3+SO
===CaCO3+SO![]() ,總反應的離子方程式為CaSO4+2NH3·H2O+CO2===CaCO3+2NH
,總反應的離子方程式為CaSO4+2NH3·H2O+CO2===CaCO3+2NH![]() +SO
+SO![]() +H2O。
+H2O。
A.攪拌漿料,可增大反應物的接觸面積,加快化學反應速率;B.加熱漿料,由于NH3的揮發,導致NH3·H2O濃度降低,不利于CO![]() 的生成,降低了CaSO4的轉化速率;C.增大氨水濃度,有利于提高CO
的生成,降低了CaSO4的轉化速率;C.增大氨水濃度,有利于提高CO![]() 的濃度,從而提高CaSO4的轉化速率;D. 減小CO2通入速率,不利于CO
的濃度,從而提高CaSO4的轉化速率;D. 減小CO2通入速率,不利于CO![]() 的生成,從而降低CaSO4的轉化速率。
的生成,從而降低CaSO4的轉化速率。
(2)由圖象可知,pH=6.5時,溶液中的c(Ca2+)已經很小,此時通入的CO2與溶液中濃度較低的氨水反應生成NH4HCO3,故溶液中物質的量濃度最大的兩種陰離子為SO![]() 和HCO
和HCO![]() 。過濾得到的CaCO3沉淀上會附著SO
。過濾得到的CaCO3沉淀上會附著SO![]() 、NH
、NH![]() 、HCO
、HCO![]() 等雜質離子。檢驗洗滌是否完全時,可取少量最后一次從過濾器中流出的洗滌液于試管中,向其中滴加鹽酸酸化的BaCl2溶液,檢驗是否存在SO
等雜質離子。檢驗洗滌是否完全時,可取少量最后一次從過濾器中流出的洗滌液于試管中,向其中滴加鹽酸酸化的BaCl2溶液,檢驗是否存在SO![]() 即可。若不產生白色沉淀,表明沉淀已洗滌完全。
即可。若不產生白色沉淀,表明沉淀已洗滌完全。
(3)NH4Cl溶液中存在水解平衡:NH![]() +H2O
+H2O![]() NH3·H2O+H+,溫度升高,上述水解平衡右移,c(H+)增大,導致部分CaCO3溶解。
NH3·H2O+H+,溫度升高,上述水解平衡右移,c(H+)增大,導致部分CaCO3溶解。


科目:高中化學 來源: 題型:
【題目】為驗證氧化性Cl2>Fe3+>SO2,某小組用下圖所示裝置進行實驗(夾持儀器和甲中加熱裝置已略,氣密性已檢驗)。
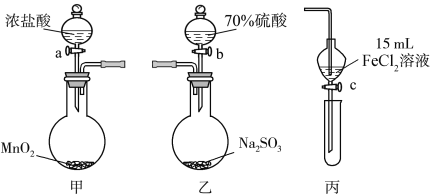
實驗步驟:
1.在甲裝置中,打開活塞a,加熱,待裝置中充滿黃綠色氣體時,與丙裝置連接。
2.當丙裝置中FeCl2溶液變黃時,停止加熱。
3.打開活塞c,使約2 mL的溶液滴入試管中,檢驗溶液中的離子。
4.在乙裝置中,打開活塞b,待空氣排盡后,將乙中產生的氣體通入上述丙裝置變黃后的溶液中,一段時間后,停止。
5.更新丙中試管,打開活塞c,使約2 mL的溶液滴入試管中,檢驗溶液中的離子。
回答下列問題:
(1)甲中發生反應的化學方程式為_____________________。
(2)用70%的硫酸制取SO2,反應速率比用98%的硫酸快,原因是______________。
(3)實驗中,證明氧化性Fe3+>SO2的離子方程式為_________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三組同學分別完成了上述實驗,實驗結果如下:
步驟3溶液中含有的離子 | 步驟5溶液中含有的離子 | |
Ⅰ | 既有Fe3+又有Fe2+ | 有SO |
Ⅱ | 有Fe3+無Fe2+ | 有SO |
Ⅲ | 有Fe3+無Fe2+ | 有Fe2+ |
上述實驗結果一定能夠證明氧化性Cl2>Fe3+>SO2的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組同學展開對漂白劑亞氯酸鈉(NaClO2)的研究。
實驗Ⅰ:制取NaClO2晶體。
已知:NaClO2飽和溶液在溫度低于38 ℃時析出的晶體是NaClO2·3H2O,高于38 ℃時析出的晶體是NaClO2,高于60 ℃時NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。利用下圖所示裝置進行實驗。
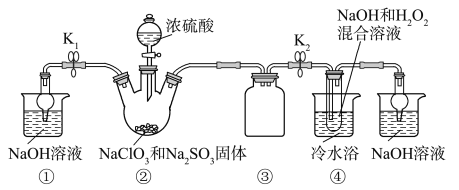
(1)裝置①的作用是_______________,裝置③的作用是______________________。
(2)裝置②中產生ClO2氣體的化學方程式為________________________。
(3)從裝置④反應后的溶液獲得晶體NaClO2的操作步驟為:
①減壓,55 ℃蒸發結晶;
②趁熱過濾;
③________________________;
④低于60 ℃干燥,得到成品。
實驗Ⅱ:測定某亞氯酸鈉樣品的純度。設計如下實驗方案,并進行實驗。
①準確稱取所得亞氯酸鈉樣品m g于燒杯中,加入適量蒸餾水和過量的碘化鉀晶體,再滴入適量的稀硫酸,充分反應(已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-)。將所得混合液配成100 mL待測溶液。
+4I-+4H+===2H2O+2I2+Cl-)。將所得混合液配成100 mL待測溶液。
②移取25.00 mL待測溶液于錐形瓶中,用c mol·L-1 Na2S2O3標準液滴定,至滴定終點。重復2次,測得消耗標準溶液的體積的平均值為V mL(已知:I2 +2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。
)。
(4)樣品中NaClO2的質量分數為__________(用含m、c、V的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學興趣小組探究SO2與FeCl3溶液的反應,所用裝置如下圖所示。
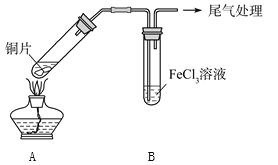
(1)該小組同學預測SO2與FeCl3溶液反應的現象為溶液由棕黃色變成淺綠色,然后開始實驗。
步驟① | 配制1 mol·L-1FeCl3溶液(未用鹽酸酸化),測其pH約為1,取少量裝入試管B中,加熱A |
FeCl3溶液顯酸性的原因是__________________。寫出裝置A中產生SO2的化學方程式:_______________________________。
(2)當SO2通入FeCl3溶液至飽和時,同學們觀察到的現象是溶液由棕黃色變成紅棕色,沒有觀察到丁達爾現象。將混合液放置12小時,溶液才變成淺綠色。
【查閱資料】[Fe(HSO3)]2+為紅棕色,它可以將Fe3+還原為Fe2+。生成
[Fe(HSO3)]2+的反應為可逆反應。
解釋SO2與FeCl3溶液反應生成紅棕色[Fe(HSO3)]2+的原因:_________________________。
寫出溶液中[Fe(HSO3)]2+與Fe3+反應的離子方程式: ________________________。
(3)為了探究如何縮短紅棕色變為淺綠色的時間,該小組同學進行了步驟②、③的實驗。
步驟② | 往5 mL 1 mol·L-1FeCl3溶液中通入SO2氣體,溶液立即變為紅棕色。微熱3 min,溶液顏色變為淺綠色 |
步驟③ | 往5 mL重新配制的1 mol·L-1FeCl3溶液(用濃鹽酸酸化)中通入SO2氣體,溶液立即變為紅棕色。幾分鐘后,發現溶液顏色變成淺綠色 |
用鐵氰化鉀溶液檢驗步驟②和步驟③所得溶液中的Fe2+,其現象為____________________。
(4)綜合上述實驗探究過程,可以獲得的實驗結論:
Ⅰ.SO2與FeCl3溶液反應生成紅棕色中間產物[Fe(HSO3)]2+;
Ⅱ.紅棕色中間產物轉變成淺綠色溶液是一個較慢的過程;
Ⅲ.____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生物質資源是一種污染小的可再生能源,生物質的主要轉化途徑及主要產物如圖。
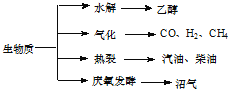
(1)下列有關說法正確的是
A.生物質能,本質上能量來源于太陽能
B.由纖維素水解獲得的乙醇屬生物質能
C.生物質裂解獲得的汽油、柴油等屬于純凈物
D.由植物秸稈等發酵獲得的沼氣,主要成分是甲烷
(2) 由生物質能獲得的CO和H2,當兩者1: 1催化反應,其原子利用率達100%,合成的物質可能是________。
A.汽油 B.甲醇 C.甲醛(HCHO) D.乙酸
(3) 已知在生物質氣化爐中可發生:
C(s)+CO2(g)═2CO(g);△H=+172kJ/mol
CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206kJ/mol
CH4(g)+2H2O(g)═CO2(g)+4H2(g);△H=+165kJ/mol
則C(s)+H2O(g)═CO(g)+H2(g);△H=____________kJ/mol.
(4)由生物質能獲得的CO和H2可以用來合成液態燃料甲醇,實驗測得,5g甲醇在氧氣中充分燃燒生成二氧化碳氣體和液態水時釋放出113.5kJ的熱量,試寫出甲醇燃燒的熱化學方程式:_________________。
(5) 己知稀溶液中,1molH2SO4與NaOH溶液恰好完全反應時,放出114.6kJ熱量,寫出表示H2SO4與NaOH反應的中和熱的熱化學方程式_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】七鋁十二鈣(12CaO·7Al2O3)是新型的超導材料和發光材料。用白云石(主要含CaCO3和MgCO3)和廢Al片制備七鋁十二鈣的工藝如下:
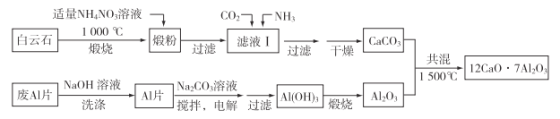
(1)煅粉主要含MgO和____________,用適量NH4NO3溶液浸取煅粉后,鎂化合物幾乎不溶;若濾液Ⅰ中c(Mg2+)小于5×10-6 mol·L-1,則溶液pH大于________[Mg(OH)2的Ksp=5×10-12];該工藝中不能用(NH4)2SO4代替NH4NO3,原因是_________________。
(2)濾液Ⅰ中的陰離子有________(忽略雜質成分的影響);若濾液Ⅰ中僅通入CO2,會生成_________________,從而導致CaCO3產率降低。
(3)用NaOH溶液可除去廢Al片表面的氧化膜,反應的離子方程式為____________。
(4)電解制備Al(OH)3時,電極分別為Al片和石墨,電解總反應方程式為____________。
(5)一種可超快充電的新型鋁電池,充放電時AlCl![]() 和Al2Cl
和Al2Cl![]() 兩種離子在Al電極上相互轉化,其他離子不參與電極反應,放電時負極Al的電極反應式為__________________________________。
兩種離子在Al電極上相互轉化,其他離子不參與電極反應,放電時負極Al的電極反應式為__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學購買了一瓶“84消毒液”,包裝說明如下:
凈含量:1 000 mL 密度:1.19 g·cm-3
主要成分:25%NaClO
使用方法:稀釋100倍(體積比)后使用
注意事項:密封保存,易吸收空氣中的CO2變質
請根據以上信息和相關知識判斷,下列分析不正確的是( )
A.該“84消毒液”的物質的量濃度約為4.0 mol·L-1
B.一瓶該“84消毒液”能吸收空氣中44.8 L的CO2(標準狀況)而變質
C.取100 mL該“84消毒液”稀釋100倍后用以消毒,稀釋后的溶液中c(Na+)約為0.04 mol·L-1
D.參閱該“84消毒液”的配方,欲用NaClO固體配制含25%NaClO的消毒液480 mL,需要稱量的NaClO固體質量為143 g
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com