
 A、B、C、D、E、F、G是原子序數依次增大的七種元素,其中A~F為短周期主族元素,G為第四周期元素.已知:A是原子半徑最小的元素,B和D同周期,固態的BD2能升華,E、F在B、D的下一周期,且E原子的最外層電子數與次外層電子數之比為3:4;G的質子數比F多12.請回答:
A、B、C、D、E、F、G是原子序數依次增大的七種元素,其中A~F為短周期主族元素,G為第四周期元素.已知:A是原子半徑最小的元素,B和D同周期,固態的BD2能升華,E、F在B、D的下一周期,且E原子的最外層電子數與次外層電子數之比為3:4;G的質子數比F多12.請回答:分析 A、B、C、D、E、F、G是原子序數依次增大的七種元素,其中A~F為短周期主族元素,A是原子半徑最小的元素,則A為H元素;E原子的最外層電子數與次外層電子數之比為3:4,原子只能有3個電子層,最外層電子數為6,故E為S元素,可推知F為Cl;E、F在B、D的下一周期,B和D同周期,則B、D處于第二周期,固態的BD2能升華,應是CO2,則B為碳元素、D為O元素;C的原子序數介于碳、氧之間,故C為N元素;G的質子數比F多12,故G的質子數為17+12=29,故G為Cu,據此解答.
解答 解:A、B、C、D、E、F、G是原子序數依次增大的七種元素,其中A~F為短周期主族元素,A是原子半徑最小的元素,則A為H元素;E原子的最外層電子數與次外層電子數之比為3:4,原子只能有3個電子層,最外層電子數為6,故E為S元素,可推知F為Cl;E、F在B、D的下一周期,B和D同周期,則B、D處于第二周期,固態的BD2能升華,應是CO2,則B為碳元素、D為O元素;C的原子序數介于碳、氧之間,故C為N元素;G的質子數比F多12,故G的質子數為17+12=29,故G為Cu.
(1)G為Cu,原子核外電子數為29,基態原子核外電子排布式為:1s22s22p63s23p63d104s1;同周期隨原子序數增大,元素第一電離能呈增大趨勢,但N元素原子2p能級容納3個電子,為半滿穩定狀態,能量較低,第一電離能高于同周期相鄰元素,故第一電離能由小到大的順序為C<O<N,
故答案為:1s22s22p63s23p63d104s1;C<O<N;
(2)NH3分子的空間立體構型為:三角錐形;硫酸銅與過量的NH3水溶液反應得到含配離子的深藍色溶液,該配離子的化學式為[Cu(NH3)4]2+,
故答案為:[Cu(NH3)4]2+;
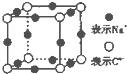
(3)元素C的簡單離子與晶胞棱中心的Na+離子距離最近,每個頂點為8個晶胞共用,每個鈉離子為4個晶胞共用,故Cn-的配位數為3×8×$\frac{1}{4}$=6,
故答案為:6;
(4)工業上將干燥的氯氣通入熔融的硫單質中制得化合物S2Cl2,該物質可與水反應生成一種能使品紅溶液褪色的氣體,該氣體為SO2,反應中只有一種元素化合價發生改變,即只有S元素化合價發生變化,S2Cl2中S元素平均化合價為+1,0.2molS2Cl3含有0.4molS原子,0.2molS2Cl3反應時轉移0.3mol電子,則被氧化的S原子為$\frac{0.3mol}{4-1}$=0.1mol,被氧化物的S原子為0.4mol-0.1mol=0.3mol,設S元素在還原產物中的化合價為x,則(1-x)×0.3=0.3,解得x=0,故還原產物為S,由元素守恒可知,有水參與反應,同時生成HCl,該反應的化學方程式為:2S2Cl2+2H2O=3S↓+SO2↑+4HCl,
故答案為:2S2Cl2+2H2O=3S↓+SO2↑+4HCl;
(5)已知298K時,碳和CO的燃燒熱分別為-393.5KJ/mol、-283KJ/mol,則:
①C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1
根據蓋斯定律:①×2-②×2得:2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
或者①-②×2得:C(s)+CO2(g)=2CO(g)△H=+172.5kJ•mol-1
故答案為:2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1 或C(s)+CO2(g)=2CO(g)△H=+172.5kJ•mol-1.
點評 本題比較綜合,涉及電離能、分子空間構型、配合物、晶胞計算、氧化還原反應方程式書寫、熱化學方程式書寫等,推斷元素是解題的關鍵,需要學生具備扎實的基礎,(5)中注意沒有明確轉化方程式.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | H2PO4-+H2O?HPO42-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | -770 kJ/mol | B. | -l220 kJ/mol | C. | -1500kJ/mol | D. | -2740kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
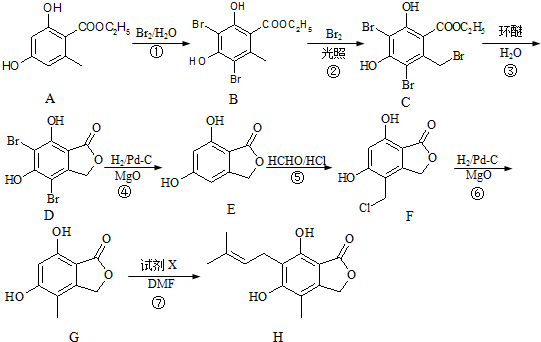
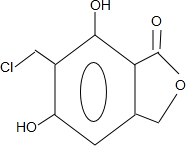 (任寫一種).
(任寫一種).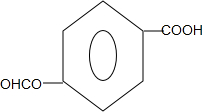 .
.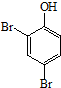 、HCHO為原料制備
、HCHO為原料制備 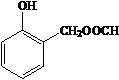 合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:
合成路線流程圖(無機試劑任用).合成路線流程圖示例如下: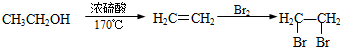
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
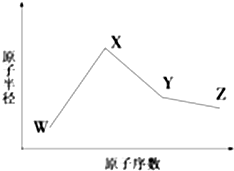 W、X、Y、Z、M、N是六種常見的短周期元素,其中W、X、Y、Z原子半徑隨原子序數變化如圖所示.已知W的一種核素的質量數為18,中子數為10;X和Ne原子的核外電子數相差1;Y的單質是一種常見的半導體材料;Z的非金屬性在同周期主族元素中最強.M的原子序數比Y小1,N元素最高化合價是最低化合價絕對值的3倍.
W、X、Y、Z、M、N是六種常見的短周期元素,其中W、X、Y、Z原子半徑隨原子序數變化如圖所示.已知W的一種核素的質量數為18,中子數為10;X和Ne原子的核外電子數相差1;Y的單質是一種常見的半導體材料;Z的非金屬性在同周期主族元素中最強.M的原子序數比Y小1,N元素最高化合價是最低化合價絕對值的3倍.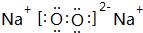 ,
,查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ca(ClO)2溶液中通入CO2,溶液變渾濁,再加入品紅溶液,紅色褪去 | |
| B. | 碳跟濃硫酸共熱產生的氣體X和銅跟濃硝酸反應產生的氣體Y同時通入裝有足量氯化鋇溶液的洗氣瓶中(如圖裝置),洗氣瓶中產生的沉淀是硫酸鋇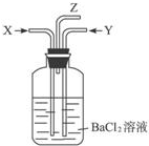 | |
| C. | 向Na2CO3溶液中逐滴加入等物質的量的稀鹽酸,生成的CO2與原Na2CO3的物質的量之比為1:2 | |
| D. | 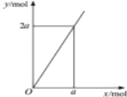 鋅與不同濃度的硝酸可發生不同的反應(如圖:y表示耗去Zn的物質的量,x表示被還原的硝酸的物質的量),4Zn+10HNO3(極稀)=4Zn(NO3)2+5H2O+N2O↑符合圖示 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下1L0.1mol/LNH4Cl溶液與2L0.05mol/LNH4Cl溶液中c(NH4+)相等 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4NO3溶液中,c(H+)相等 | |
| C. | pH=6的CH3COOH和CH3COONa混合液中:c(Na+)+c(OH-)-c(CH3COO-)=10-6mol/L | |
| D. | pH=9的NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第n周期的最后一種金屬元素處在第n-1族(1<n<7,n為正整數) | |
| B. | m=1和m=7(m為最外層電子數)的元素單質能形成的化合物都是離子化合物 | |
| C. | m-n=5(m為最外層電子數,n為電子層數)的主族元素存在最強的對應含氧酸 | |
| D. | 第n周期有n種主族金屬元素(1<n<7,n為正整數) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHB屬于弱電解質 | |
| B. | 溶液中的離子濃度c(Na+)>c(HB-)>c(H+)>c(OH-) | |
| C. | NaHB和NaOH溶液反應的離子方程式為H++OH-═H2O | |
| D. | c(Na+)=c(HB-)+c(B2-)+c(H2B) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com