解答:
解:(1)平衡狀態的判斷依據是正逆反應速率相等,各組分的濃度保持不變,
A、反應物A與B加入的反應物的物質的量之比等于其化學計量數之比,所以平衡后A與B的轉化率之比等于化學計量數之比為1:2,故A正確;
B、當2v
正(A)=v
逆(B)時,說明正逆反應速率相等,反應達到平衡狀態,故B正確;
C、轉化率為x,則平衡后有A、B、C物質的量分別為n-nx、2n-nx、2nxmol,平衡后氣體總物質的量為3n-nx,恒容容器中,氣體物質的量之比等于其壓強之比,故C正確;
D、恒容容器中,充入惰性氣體(如Ar),平衡不移動,故D錯誤;
故選ABC;
(2)在容積固定的V L密閉容器里加入n mol A、2n mol B,發生反應:A(g)+2B(g)
2C(g)△H<0,反應達平衡后測得平衡常數為K,此時A的轉化率為x,
A(g)+2B(g)
2C(g)
起始量(mol) n 2n 0
變化量(mol) nx 2nx 2nx
平衡量(mol) n-nx 2n-2nx 2nx
平衡濃度為,c(A)=
mol/L,c(B)=
mol/L,c(C)=
mol/L
平衡常數K=
=
=
,
增大容器體積時,c(B)和c(C)等比例減小,由于A的濃度不變,此時
的值仍然等于K,所以平衡不移動;
故答案為:
;C;
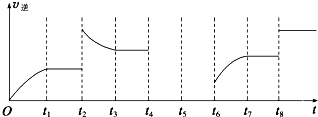
(3)由于縱坐標只表示v
逆,為了便于求解,在解題時可把v
正補上,t
2時平衡逆向移動,采用的條件可以是升溫或增大C的濃度;t
8時平衡不移動,采用的條件是使用了催化劑.
①該反應是一個反應前后氣體體積減小的且是正反應是放熱的化學反應,t
2時逆反應速率增大,且平衡時反應速率大于t
2時反應速率,平衡向逆反應方向移動,改變的條件為增大生成物C濃度或升高溫度,t
8時平衡不移動,采用的條件是使用了催化劑.
故答案為:增大生成物C濃度或升高溫度;使用催化劑;
②t
2時逆反應速率增大,且平衡時反應速率大于t
2時反應速率,平衡向逆反應方向移動,故答案為:逆反應.

 一定溫度下,在容積固定的V L密閉容器中加入n mol A、2n mol B,發生反應:A(g)+2B(g)??2C(g)△H<0,反應達平衡后測得平衡常數為K,此時A的轉化率為x.根據以上條件,回答下列問題:
一定溫度下,在容積固定的V L密閉容器中加入n mol A、2n mol B,發生反應:A(g)+2B(g)??2C(g)△H<0,反應達平衡后測得平衡常數為K,此時A的轉化率為x.根據以上條件,回答下列問題:

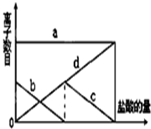 少量的K2CO3溶液中緩慢地滴加稀鹽酸,并不斷攪拌.隨著鹽酸的加入,溶液中離子數目也相應地發生如圖變化.四條曲線(c和d圖象部分重疊)溶液中離子的對應關系,正確的是( )
少量的K2CO3溶液中緩慢地滴加稀鹽酸,并不斷攪拌.隨著鹽酸的加入,溶液中離子數目也相應地發生如圖變化.四條曲線(c和d圖象部分重疊)溶液中離子的對應關系,正確的是( )
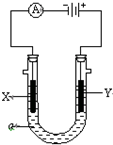 (1)鋼鐵容易生銹的主要原因是因為鋼鐵在煉制過程中混有少量的碳雜質,在潮濕的空氣中容易形成原電池,發生電化學腐蝕.在空氣酸度很小的環境中,該原電池的負極是
(1)鋼鐵容易生銹的主要原因是因為鋼鐵在煉制過程中混有少量的碳雜質,在潮濕的空氣中容易形成原電池,發生電化學腐蝕.在空氣酸度很小的環境中,該原電池的負極是