
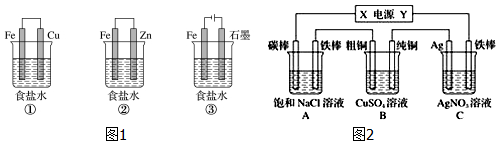
分析 (1)工業上冶煉鋁是電解熔融的氧化鋁得到;
(2)電池總反應為4Al+3O2+6H2O═4Al(OH)3,原電池中鋁失電子做負極被氧化;
(3)①裝置為原電池鐵為負極被腐蝕;②裝置為原電池鋅做負極被腐蝕,鐵做正極被保護,稱為犧牲陽極的陰極保護法;③裝置為電解池,鐵做陰極被保護,根據電極的腐蝕速率關系來判斷;
(4)如圖2所示,若電解5min時C池中鐵棒質量增加2.16g,則鐵棒為陰極,Ag電極為陽極,依次純銅做陰極,粗銅做陽極,A中鐵棒做陰極,碳棒做陽極,X為正極,Y為負極,據此書寫電極反應,結合電解過程中電極上電子守恒計算.
解答 解:(1)工業上冶煉鋁的化學方程式是:2Al2O3$\frac{\underline{\;通電\;}}{\;}$4Al+3O2↑,
故答案為:2Al2O3$\frac{\underline{\;通電\;}}{\;}$4Al+3O2↑;
(2)我國首創的海洋電池以鋁板為負極,鉑網為正極,海水為電解質溶液,空氣中的氧氣與鋁反應產生電流.電池總反應為4Al+3O2+6H2O═4Al(OH)3,鋁做負極失電子被氧化,則負極反應式為:Al-3e-=Al3+,
故答案為:Al-3e-=Al3+;
(3)①裝置為原電池鐵為負極被腐蝕;②裝置為原電池鋅做負極被腐蝕,鐵做正極被保護;③裝置為電解池,鐵做陰極被保護;①組裝置中鐵電極腐蝕最快,正極反應是氧氣得到電子發生還原反應,電極反應為:O2+2H2O+4e-=4OH-;②中負極上金屬鋅失電子,電極反應為:Zn-2e-=Zn2+,金屬鐵被保護,此時金屬鐵可以采犧牲陽極的陰極保護法,裝置③中發生的是電解飽和食鹽水的反應,陽極是氯離子失電子生成氯氣,陰極是氫離子得到電子發生還原反應,陰極鐵被保護,
故答案為:①;②③;
(4)如圖2所示,若電解5min時C池中鐵棒質量增加2.16g,則C中鐵棒為陰極,電極反應為:Ag++e-=Ag,增大的質量為析出銀的質量,物質的量=$\frac{2.16g}{108g/mol}$=0.02mol,電子轉移總物質的量為0.02mol,Ag電極為陽極,電極反應為:Ag-e-=Ag+,C池為電鍍池電解質溶液中溶質濃度不變,
分析判斷,B裝置中依次純銅做陰極,電極反應為Cu2++2e-=Cu,粗銅做陽極,電極反應為Cu-2e-=Cu2+,A裝置中鐵棒做陰極,電極反應為:2H++2e-=H2↑,碳棒做陽極,電極反應為:2Cl--2e-=Cl2↑,X為正極,Y為負極,
故答案為:負極; 0.02mol; 2Cl--2e-=Cl2↑;Cu-2e-=Cu2+;不變.
點評 本題考查了金屬腐蝕與防護的方法和應用、原電池和電解池的工作原理應用知識,注意原電池電極反應書寫方法是基礎,題目難度中等.


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源: 題型:選擇題
| 編號 | 試劑 | 保存方法 | 理由 |
| A | 水玻璃 | 存放在帶橡皮塞的細口瓶中,密封 | 防止與空氣接觸被氧化和與二氧化碳接觸而變質 |
| B | 硫酸亞鐵晶體 | 存放在帶玻璃塞的廣口瓶中,密封 | 防止與空氣接觸被氧化 |
| C | 濃硫酸 | 密閉保存 | 防止吸水和揮發 |
| D | 新制的溴水 | 存放在無色試劑瓶中,密封 | 防止揮發 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸的電離方程式:H2SO4=H2++SO42- | |
| B. | 光導纖維主要成分的化學式:Si | |
| C. | 質子數為53,中子數為78的碘原子:${\;}_{53}^{131}$I | |
| D. | 鈉離子的結構示意圖: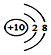 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
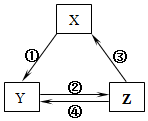 表所列各組物質中,物質之間通過一步反應就能實現如圖所示轉化且所給反應條件正確的是( )
表所列各組物質中,物質之間通過一步反應就能實現如圖所示轉化且所給反應條件正確的是( )| 選項 | X | Y | Z | 箭頭上所標數字的反應條件 |
| A | SiO2 | Na2SiO3 | H2SiO3 | ①與Na2CO3熔融 |
| B | Na | Na2O2 | NaCl | ②加H2O |
| C | NO | NO2 | HNO3 | ③與C加熱 |
| D | Al2O3 | NaAlO2 | Al(OH)3 | ④與NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | O2、O3是同一種單質 | |
| B. | 1H、2H、3H、H+、H2是氫元素形成的五種不同粒子 | |
| C. | 正丁烷和異丁烷互為同系物 | |
| D. | 乙醇、乙醚互為同分異構體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com