
| 實驗變量 實驗序號 | 銀氨溶液 /mL | 乙醛的量 /滴 | 水液溫度/℃ | 反應混合液的PH | 出現銀鏡時間/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
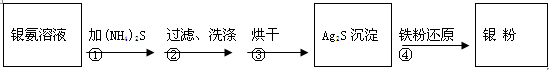
 2 Ag+ FeCl2+H2S↑。
2 Ag+ FeCl2+H2S↑。
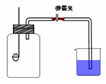
 2 Ag+ FeCl2+H2S↑,反應放出的硫化氫氣體有毒,因此該過程需要在通風櫥中進行,多余的尾氣需要用廢堿液吸收處理,不能直接排入空氣,以免污染環境;(6)銀不溶于非氧化酸,實驗室常用稀硝酸或濃硝酸氧化銀,即3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O或Ag+2HNO3(濃)=AgNO3+NO2↑+H2O。
2 Ag+ FeCl2+H2S↑,反應放出的硫化氫氣體有毒,因此該過程需要在通風櫥中進行,多余的尾氣需要用廢堿液吸收處理,不能直接排入空氣,以免污染環境;(6)銀不溶于非氧化酸,實驗室常用稀硝酸或濃硝酸氧化銀,即3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O或Ag+2HNO3(濃)=AgNO3+NO2↑+H2O。

科目:高中化學 來源:不詳 題型:實驗題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
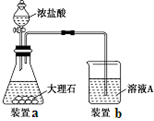

查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
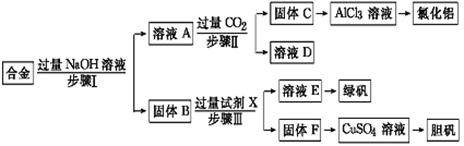
 ,則混合物中Cu2O的質量分數為 。
,則混合物中Cu2O的質量分數為 。| 物 質 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 開始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
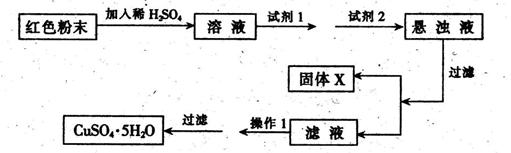
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.除去NaCl溶液中的Cl2,可加入酒精后分液 |
| B.滴定管用蒸餾水洗凈后,直接裝入標準濃度的溶液滴定 |
| C.用排水法收集稀HNO3和Cu反應產生的NO氣體 |
| D.用KSCN溶液和氯水鑒別FeCl3溶液中是否含有FeCl2 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.配制FeCl3溶液時,將FeCl3溶解在較濃的鹽酸中,再用水稀釋到所需濃度 |
| B.進行焰色反應時,所用鉑絲先用NaOH溶液洗滌并充分灼燒 |
| C.用CCl4萃取碘水中的I2時,有機層從分液漏斗的上端倒出 |
| D.酸堿中和滴定時,錐形瓶需用待測液潤洗2次,再加入待測液 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
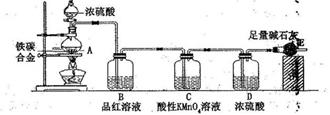
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| pH | 6.5~8.5 |
| Ca2+、Mg2+ | <0.004 5 mol·L-1 |
| 細菌總數 | <100個/mL |
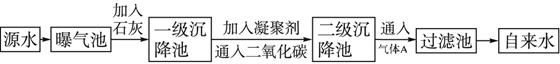
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com