用98%的濃硫酸(其密度為1.84g/cm3)配制100mL1.0mol?L-1稀硫酸.
(1)需量取濃硫酸的體積為 mL(保留一位小數)
(2)若實驗儀器有:(A)100mL量筒(B)托盤天平(C)玻璃棒(D)50mL容量瓶(E)10mL量筒 (F)膠頭滴管 (G)50mL燒杯 (H)100mL容量瓶
實驗時選用的儀器除C、F、G外還應選用 (填序號)
(3)配制過程中,下列情況會使配制結果偏高的是 (填序號)
(A)定容時俯視刻度線觀察液面; (B)容量瓶使用時未干燥;
(C)定容后經振蕩、搖勻、靜置,發現液面低于刻度線,再加蒸餾水補至刻度線
(4)在容量瓶的使用中,下列操作不正確的是 (填序號)
(A)使用容量瓶前檢查它是否漏水
(B)容量瓶用蒸餾水洗凈后,不用待配制的溶液洗滌
(C)將氫氧化鈉固體放在天平托盤的濾紙上,準確稱量并放入燒杯中溶解后,立即注入容量瓶中
(D)將準確量取的18.4mol?L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度線
(5)若配制時,因滴加蒸餾水不慎略超過了容量瓶刻度線,此時實驗應如何繼續進行?
答: .
【答案】
分析:(1)先根據C=
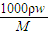
計算濃硫酸的濃度,再根據濃硫酸稀釋前后溶質的物質的量不變計算濃硫酸的體積;
(2)根據儀器的作用選取儀器;
(3)根據c=
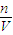
分析判斷誤差;
(4)根據實驗操作的規范性判斷;
(5)若加蒸餾水時不慎超過了刻度線,應重新配制.
解答:解:(1)濃硫酸的物質的量濃度C=
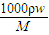
=
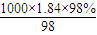
mol/L=18.4mol/L,設濃硫酸的體積為V,18.4mol/L×V=1.0mol/L×0.1L,V=0.0054L=5.4mL,故答案為:5.4;
(2)量取濃硫酸的10mL量筒,配制溶液的100mL容量瓶,故選EH;
(3)(A)定容時俯視刻度線觀察液面,溶液的體積偏小,配制溶液的濃度偏高;
(B)容量瓶使用時未干燥,溶質的物質的量和溶液的體積不變,配制溶液濃度不變;
(C)定容后經振蕩、搖勻、靜置,發現液面低于刻度線,再加蒸餾水補至刻度線,溶液的體積偏大,配制溶液的濃度偏低,故選A;
(4)(A)使用容量瓶前檢查它是否漏水,否則配制溶液濃度不準確,故正確;
(B)容量瓶用蒸餾水洗凈后,不能用待配制的溶液洗滌,否則,溶質的物質的量偏大,配制溶液濃度偏高,故正確;
(C)氫氧化鈉具有腐蝕性,應該放在小燒杯中稱量,且氫氧化鈉溶解時放出熱量,應該等溶液冷卻到室溫時再轉移溶液,故錯誤;
(D)容量瓶不能用來稀釋溶液,故錯誤;
故選CD;
(5)若加蒸餾水時不慎超過了刻度線,應重新配制,故答案為:重新配制.
點評:本題考查一定物質的量濃度溶液的配制,注意容量瓶和量筒規格的選取方法,為易錯點.

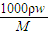 計算濃硫酸的濃度,再根據濃硫酸稀釋前后溶質的物質的量不變計算濃硫酸的體積;
計算濃硫酸的濃度,再根據濃硫酸稀釋前后溶質的物質的量不變計算濃硫酸的體積;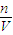 分析判斷誤差;
分析判斷誤差;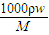 =
=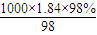 mol/L=18.4mol/L,設濃硫酸的體積為V,18.4mol/L×V=1.0mol/L×0.1L,V=0.0054L=5.4mL,故答案為:5.4;
mol/L=18.4mol/L,設濃硫酸的體積為V,18.4mol/L×V=1.0mol/L×0.1L,V=0.0054L=5.4mL,故答案為:5.4;

