

分析 從實驗裝置和實驗步驟上看,用足量NaOH溶液與樣品中AlN完全反應,充分吸收生成的氨氣,并稱量其質量,從而求得AlN的質量分數,以此分析解答;
(1)根據題目信息:AlN溶于強堿溶液時會生成NH3來書寫方程式;
(2)氨氣極易溶于水和濃硫酸發生反應,C裝置中球形干燥管可以防止倒吸;
(3)①利用裝置生成氣體,測定氣體質量完成含量測定,裝置必須密閉不漏氣;
③用足量NaOH溶液與樣品中AlN完全反應,充分吸收生成的氨氣,并稱量其質量,故應關閉活塞K1,打開活塞K2;
④裝置中殘留部分氨氣,打開K1,通入氮氣一段時間,用氮氣把裝置內生成的氨氣全部趕到濃硫酸中被吸收,裝置B是吸收氨氣中的水蒸氣;
(4)①根據氮原子的守恒,氨氣的物質的量等于AlN的物質的量,可求得AlN的質量分數;
②裝置C處濃硫酸會吸收空氣中的水蒸氣使測定氨氣質量增大.
解答 解:(1)根據題目信息:AlN溶于強堿溶液時會生成NH3,化學方程式為:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案為:AlN+NaOH+H2O=NaAlO2+NH3↑;
(2)氨氣極易溶于水和濃硫酸發生反應,C裝置中球形干燥管上部面積較大可以防止倒吸,避免產生危險,導致測定結果不準確,
故答案為:防止倒吸;
(3)①利用裝置生成氣體,測定吸收氣體質量來完成含量測定,裝置必須密閉不漏氣,連接好實驗裝置,先檢驗裝置的氣密性,然后稱得C裝置的質量為yg為吸收氨氣的質量,
故答案為:檢驗裝置的氣密性;
②用足量NaOH溶液與樣品中AlN完全反應,充分吸收生成的氨氣,并稱量其質量,故應關閉活塞K1,打開活塞K2,使生成的氨氣被濃硫酸全部吸收,通過分液漏斗加入NaOH濃溶液,至不再產生氣體.打開K1,通入氮氣一段時間,稱得C裝置的質量變為zg.通入氮氣的目的是把裝置中殘留的氨氣全部趕入C裝置,使氨氣被充分吸收,避免氨氣中的水蒸氣影響測定結果,通過裝置B中的堿石灰吸收水蒸氣,對氨氣進行干燥,
故答案為:K1;K2;把裝置中殘留的氨氣全部趕入C裝置,使氨氣被充分吸收,干燥氨氣;
(4)①氨氣的質量為(z-y)g,物質的量為$\frac{z-y}{17}$mol,根據氮原子的守恒,氨氣的物質的量等于AlN的物質的量,所以AlN的質量為$\frac{z-y}{17}$mol×41g/mol=$\frac{41(x-y)}{17}$g,故AlN的質量分數為$\frac{\frac{41(z-y)}{17}}{x}$×100%=$\frac{41(z-y)}{17x}$×100%,
故答案為:$\frac{41(z-y)}{17x}$×100%;
②裝置C處濃硫酸會吸收空氣中的水蒸氣使測定氨氣質量增大,改進意見C裝置出口處連接一個干燥裝置,以防止空氣中的水蒸氣進入,
故答案為:C裝置出口處連接一個干燥裝置,以防止空氣中的水蒸氣進入.
點評 本題是一道關于物質的組成和含量測定知識的綜合考查題,要求學生具有分析和解決問題的能力,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
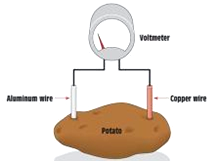 以色列研究人員宣布已研制出一種利用煮熟土豆發電的有機電池,具有構造簡單、可持續利用等特點.圖為土豆電池,這種綠色高效能的電池由鋅、銅電極和煮熟的土豆片制成的.下列關于土豆電池敘述正確的是( )
以色列研究人員宣布已研制出一種利用煮熟土豆發電的有機電池,具有構造簡單、可持續利用等特點.圖為土豆電池,這種綠色高效能的電池由鋅、銅電極和煮熟的土豆片制成的.下列關于土豆電池敘述正確的是( )| A. | 鋅為電池的正極 | |
| B. | 銅極上發生氧化反應 | |
| C. | 該電池工作時電子由鋅電極經外電路流向銅電極 | |
| D. | 該電池是將電能轉化為生物質能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
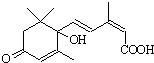 用S-誘抗素制劑,可以保證鮮花盛開.S-誘抗素的結構如圖,下列關于該物質的說法正確的是( )
用S-誘抗素制劑,可以保證鮮花盛開.S-誘抗素的結構如圖,下列關于該物質的說法正確的是( )| A. | 其分子中含有3種官能團 | |
| B. | 能發生氧化反應,又能發生取代反應 | |
| C. | 可以與FeCl3溶液發生顯色反應 | |
| D. | 1 mol該物質與NaOH溶液反應,最多消耗2 mol NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;
; +3NaOH $→_{高壓}^{高溫}$
+3NaOH $→_{高壓}^{高溫}$ +NaCl+2H2O;
+NaCl+2H2O; ;
; (任寫一種結構簡式).
(任寫一種結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
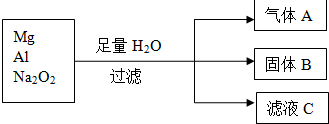
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
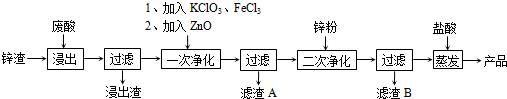
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2種 | B. | 3種 | C. | 4種 | D. | 5種 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com