
用可再生的物質制備乙酸乙酯的綠色合成路線之一如下圖所示:

下列說法正確的是
A.常溫下,M能與銀氨溶液發生反應
B.④的反應類型屬于酯化反應,不屬于取代反應
C.用飽和碳酸鉀溶液能鑒別乙醇、乙酸和乙酸乙酯.
D.淀粉和纖維素的化學式均為( C6H10O5)n,二者互為同分異構體
C
【解析】
試題分析:淀粉或纖維素完全水解得到M為葡萄糖 ,葡萄糖在酒化酶的作用下發生反應得到乙醇和CO2,產生的乙醇部分發生催化氧化反應得到乙酸,乙醇和乙酸在濃硫酸的作用下發生酯化反應(屬于取代反應)得到乙酸乙酯和水。A. M為葡萄糖,含有醛基,所以在水浴加熱時能發生銀鏡反應。錯誤。B. ④的反應類型屬于酯化反應同時也屬于取代反應。錯誤。C.乙醇能溶解在飽和碳酸鉀溶液中,不分層,沒有任何現象,而乙酸的酸性比碳酸強,所以能與碳酸鉀發生反應,產生氣體,乙酸乙酯不能溶解在飽和碳酸鉀溶液中,密度比水小,分層。因此可以用飽和碳酸鉀溶液能鑒別乙醇、乙酸和乙酸乙酯.正確。D.淀粉和纖維素的化學式雖然均為( C6H10O5)n,但是單糖單元的結構不同,聚合度不同,因此二者不是同分異構體。錯誤。
考點:考查葡萄糖的結構與性質的關系、物質的鑒別、酯化反應、同分異構體的含義及識別的知識。


科目:高中化學 來源: 題型:閱讀理解
| 通電 |
| 加熱 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年寧夏銀川一中高三(上)第三次月考化學試卷(解析版) 題型:解答題
 H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O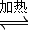 CH3OH(g)分析該反應并回答下列問題:
CH3OH(g)分析該反應并回答下列問題: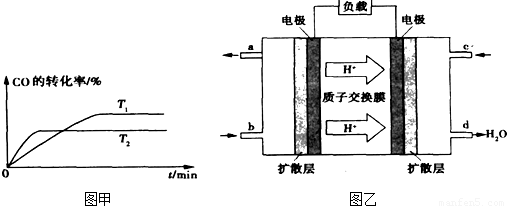
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com