
| 元素代號 | A | B | C | D | E |
| 原子半徑/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合價 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+與D2-的核外電子數相等 | |
| B. | B與E形成的化合物既能與強酸反應又能與強堿反應 | |
| C. | 原子的失電子能力:C>A | |
| D. | 單質與濃度相等的稀鹽酸反應的速率為B>A |
分析 元素的最高正價=最外層電子數,最高正價和最低負價絕對值的和為8,D、E兩元素最外層電子數為6,故為第ⅥA元素,而D的半徑大于E,E為沒有最高正價,則E為O元素,D為S元素;
B元素最外層電子數為3,為B或Al,但是半徑比氧和硫均大,故位于氧元素和硫元素的中間,應為Al;
A的半徑比鋁大,最外層電子數為2,應為Mg,C的半徑比Mg小,最外層兩個電子,故為Be,然后根據各種元素的原子在周期表中的分布位置確定它們的性質遞變規律.
解答 解:元素的最高正價=最外層電子數,最高正價和最低負價絕對值的和為8,D、E兩元素最外層電子數為6,故為第ⅥA元素,而D的半徑大于E,E為沒有最高正價,則E為O元素,D為S元素;B元素最外層電子數為3,為B或Al,但是半徑比氧和硫均大,故位于氧元素和硫元素的中間,應為Al;A的半徑比鋁大,最外層電子數為2,應為Mg,C的半徑比Mg小,最外層兩個電子,故為Be.
A、A2+是鎂離子,D2-是硫離子,它們的核外電子數分別是10和18,核外電子數不相等,故A錯誤;
B、B與E形成的化合物是氧化鋁,屬于兩性氧化物,既能與強酸反應又能與強堿反應,故B正確;
C、同主族,從上到下原子得失電子能力逐漸增強,所以失電子能力Mg>Be,故C錯誤;
D、同周期,從左到右金屬性逐漸減小,單質與濃度相等的稀鹽酸反應的速率逐漸減小,則速率:A>B,故D錯誤.
故選B.
點評 本題主要考查了學生有關元素周期表的應用知識,注意根據化合價及原子半徑來推斷元素是解題的關鍵,要熟記元素周期表中的遞變規律,學以致用,題目難度不大.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
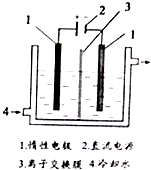 碘被稱為“智力元素”,科學合理地補充碘可防止碘缺乏病.碘酸鉀(KIO3)是國家規定的食鹽加碘劑,它的晶體為白色,可溶于水.碘酸鉀在酸性介質中與過氧化氫或碘化物作用均生成單質碘.以碘為原料,通過電解制備碘酸鉀的實驗裝置如圖所示.請回答下列問題:
碘被稱為“智力元素”,科學合理地補充碘可防止碘缺乏病.碘酸鉀(KIO3)是國家規定的食鹽加碘劑,它的晶體為白色,可溶于水.碘酸鉀在酸性介質中與過氧化氫或碘化物作用均生成單質碘.以碘為原料,通過電解制備碘酸鉀的實驗裝置如圖所示.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
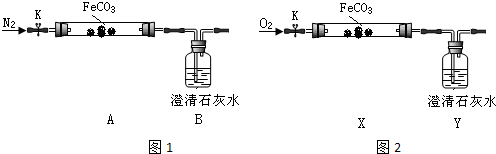
| 實驗編號 | 實驗步驟 | 實驗現象 |
| i | 向甲溶液滴加KSCN溶液 | 溶液變紅色 |
| ii | 向乙溶液滴加酸性高錳酸鉀溶液 | 溶液不褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 左下方區域的金屬元素 | B. | 金屬和非金屬分界線附近的元素 | ||
| C. | 過渡元素 | D. | 稀有氣體元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應中物質變化的實質是舊化學鍵的斷裂和新化學鍵的形成 | |
| B. | 離子化合物中一定有金屬元素和非金屬元素 | |
| C. | 全部由非金屬元素形成的化合物一定是共價化合物 | |
| D. | 共價化合物中各原子都一定滿足最外層8電子穩定結構 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
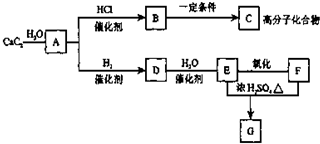 根據如圖,回答問題.
根據如圖,回答問題. ,GCH3COOCH2CH3
,GCH3COOCH2CH3查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com