
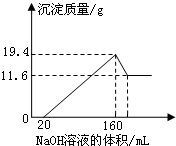
 將一定質量的鎂鋁合金樣品全部溶于100mL某濃度的鹽酸中.向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀質量與加入的NaOH溶液體積關系如圖所示.求:
將一定質量的鎂鋁合金樣品全部溶于100mL某濃度的鹽酸中.向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀質量與加入的NaOH溶液體積關系如圖所示.求:| n |
| V |
| 7.8g |
| 78g/mol |
| 11.6g |
| 58g/mol |
| 0.8mol |
| 0.1L |


科目:高中化學 來源: 題型:
 將一定質量的鎂鋁合金投入100mL一定濃度的鹽酸中,合金完全溶解.向所得溶液中滴加濃度為5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的體積關系如圖.(橫坐標體積單位是mL,縱坐標質量單位是g)求:
將一定質量的鎂鋁合金投入100mL一定濃度的鹽酸中,合金完全溶解.向所得溶液中滴加濃度為5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的體積關系如圖.(橫坐標體積單位是mL,縱坐標質量單位是g)求:查看答案和解析>>
科目:高中化學 來源: 題型:
 某研究小組將一定質量的鎂鋁合金材料投入200mL硫酸中,固體全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量n(mol)與加入NaOH溶液的體積V(mL)的變化如圖所示.
某研究小組將一定質量的鎂鋁合金材料投入200mL硫酸中,固體全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量n(mol)與加入NaOH溶液的體積V(mL)的變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:
 將一定質量的鎂鋁合金投入100ml一定物質的量濃度的鹽酸中,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液至過量,生成沉淀的質量與加入的NaOH溶液的體積關系如圖所示.求:
將一定質量的鎂鋁合金投入100ml一定物質的量濃度的鹽酸中,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液至過量,生成沉淀的質量與加入的NaOH溶液的體積關系如圖所示.求:查看答案和解析>>
科目:高中化學 來源: 題型:
 將一定質量的鎂鋁合金投入100mL一定物質的量濃度的鹽酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到過量,生成沉淀的質量與加入的NaOH溶液的體積關系如圖所示.由圖中數據計算:
將一定質量的鎂鋁合金投入100mL一定物質的量濃度的鹽酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到過量,生成沉淀的質量與加入的NaOH溶液的體積關系如圖所示.由圖中數據計算:查看答案和解析>>
科目:高中化學 來源: 題型:
 將一定質量的鎂鋁合金投入100mL一定濃度的鹽酸中,合金完全溶解.向所得溶液中滴加濃度為5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的體積關系如圖.(橫坐標體積單位是mL,縱坐標質量單位是g)求:
將一定質量的鎂鋁合金投入100mL一定濃度的鹽酸中,合金完全溶解.向所得溶液中滴加濃度為5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的體積關系如圖.(橫坐標體積單位是mL,縱坐標質量單位是g)求:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com