
分析 ①乙酸與乙醇發生酯化反應生成乙酸乙酯和水,醇脫H,羧酸脫羥基;
②酯化反應為可逆反應,且生成水,濃硫酸具有吸水性;
③飽和碳酸鈉可中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度;
④乙醇、乙酸易溶于水,導管在液面下可發生倒吸;
⑤升高溫度可加快反應速率;
⑥酯化反應屬于取代反應.
解答 解:①乙酸與乙醇發生酯化反應生成乙酸乙酯和水,醇脫H,羧酸脫羥基,則生成乙酸乙酯的方程式為CH3COOH+CH3CH2OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案為:CH3COOH+CH3CH2OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
②酯化反應為可逆反應,且生成水,濃硫酸具有吸水性,則濃硫酸在酯化反應中起催化劑、吸水劑作用,
故答案為:催化劑、吸水劑;
③飽和碳酸鈉溶液的作用為中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度,
故答案為:中和乙酸;溶解乙醇;降低乙酸乙酯的溶解度;
④乙醇、乙酸易溶于水,導管不能在液面下可防止倒吸,故答案為:防止倒吸;
⑤升高溫度可加快反應速率,則實驗中加熱試管的目的是加快反應速率,故答案為:加快反應速率;
⑥酯化反應屬于取代反應,故答案為:取代反應.
點評 本題考查有機物的制備實驗,為高頻考點,把握制備原理、混合物分離提純、實驗技能為解答關鍵,側重分析與實驗能力的考查,注意酯化反應中飽和碳酸鈉的作用,題目難度不大.


 世紀百通主體課堂小學課時同步達標系列答案
世紀百通主體課堂小學課時同步達標系列答案 世紀百通優練測系列答案
世紀百通優練測系列答案 百分學生作業本題練王系列答案
百分學生作業本題練王系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
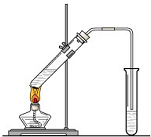 實驗室我們可以用右圖所示的裝置制取乙酸乙酯.回答下列問題:
實驗室我們可以用右圖所示的裝置制取乙酸乙酯.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | O=O | H-O |
| 鍵能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
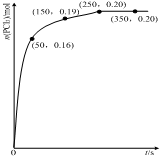 溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g) PCl3(g)+Cl2(g)經過一段時間后達到平衡.反應過程中測定的n(PCl3)隨時間的變化如圖,下列說法正確的是( )
溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g) PCl3(g)+Cl2(g)經過一段時間后達到平衡.反應過程中測定的n(PCl3)隨時間的變化如圖,下列說法正確的是( )| A. | 反應在前50 s 的平均速率v(PCl5)=0.0032 mol•L-1•s-1 | |
| B. | 該反應的平衡常數K=0.025 | |
| C. | 相同溫度下,起始時向容器中充入1.0 mol PCl5、0.20molPCl3 和0.20 mol Cl2,反應達到平衡前v(正)>v(逆) | |
| D. | 保持其他條件不變,升高溫度,平衡時:c(PCl3)=0.11mol•L-1,則反應的△H<0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
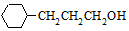 流程圖如圖
流程圖如圖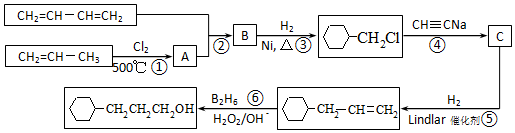
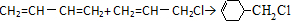 .
.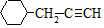 .
.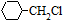 含有六元環且核磁共振氫譜有4組峰的同分異構體的結構簡式
含有六元環且核磁共振氫譜有4組峰的同分異構體的結構簡式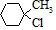 .
.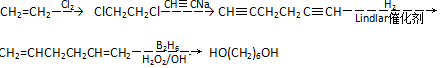 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com