

分析 (1)催化劑改變反應速率不改變化學平衡;
(2)①平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;
②圖象讀取甲醇生成濃度,結合反應速率概念計算甲醇的反應速率,依據反應速率之比等于化學方程式計量數之比得到氫氣反應速率;
③反應焓變是指1mol二氧化碳和3mol氫氣完全反應放出的熱量為49KJ,反應是可逆反應,在體積為1L的密閉容器中,充入1molCO2和3molH2,反應放熱一定小于49KJ,結合圖象中二氧化碳轉化率計算此時達到平衡放出的熱量,在相同條件下,密閉容器的體積縮小至0.5L時,壓強增大,平衡正向進行,反應放出熱量會增多;
④反應是氣體體積減小的放熱反應,升溫平衡逆向進行,增大壓強平衡正向進行,據此分析圖象確定表示的物理量;
(3)根據題意知,該反應是可逆反應,反應物是硫化氫,根據圖象知,生成物中含有S元素的物質是氫氣的一半,則生成物是S2和H2,再結合反應條件書寫方程式;(5)①由電池裝置圖可知,Cu上二氧化碳得電子生成甲烷;
②根據酸的揮發性分析;
(4)反應Ⅰ的熱化學方程式可以依據反應Ⅱ、Ⅲ熱化學方程式計算得到,同時得到反應的焓變;
(5)還原性Fe>Cu,則稀硝酸不足時鐵優先反應生成硝酸亞鐵:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,若硝酸有剩余,則銅參與反應:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,若硝酸足量,則亞鐵離子被氧化生成鐵離子,發生總反應為:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,據此對各選項進行判斷.
解答 解:(1)將煤轉化成水煤氣的反應:C(s)+H2O?CO2(g)+H2(g)可有效提高能源利用率,若在上述反應體系中加入催化劑(其他條件保持不變),催化劑改變反應速率不改變化學平衡,不改變反應焓變,此反應的△H不變,加入催化劑后反應物和生成物的總能量不變
故答案為:不變;加入催化劑后反應物和生成物的總能量不變;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反應的平衡常數表達式為:K=$\frac{c({H}_{2}O)c(C{H}_{3}OH)}{c(CO){c}^{3}({H}_{2})}$,
故答案為:$\frac{c({H}_{2}O)c(C{H}_{3}OH)}{c(CO){c}^{3}({H}_{2})}$;
②圖象讀取甲醇生成濃度,結合反應速率概念計算甲醇的反應速率=$\frac{0.75mol/L}{9min}$,反應速率之比等于化學方程式計量數之比,V(H2)=3V(CH3OH(g)=3×$\frac{0.75mol/L}{9min}$=0.25mol/L•min,
故答案為:0.25mol/L•min;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反應達到平衡狀態消耗二氧化碳物質的量濃度=1mol/L-0.25mol/L=0.75mol/L,物質的量為0.75mol,反應放出熱量=49KJ/mol×0.75mol=36.75KJ,反應焓變是指1mol二氧化碳和3mol氫氣完全反應放出的熱量為49KJ,反應是可逆反應,在體積為1L的密閉容器中,充入1molCO2和3molH2,反應放熱一定小于49KJ,在相同條件下,密閉容器的體積縮小至0.5L時,壓強增大,平衡正向進行,反應放出熱量會增多,大于36.75KJ,則36.75<Q<49,
故答案為:c;
④CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反應是氣體體積減小的放熱反應,
i.溫度升高,平衡逆向進行,二氧化碳轉化率減小,所以X為溫度,L為壓強,
故答案為:溫度;
ii.溫度一定壓強增大平衡正向進行二氧化碳轉化率增大,所以L1>L2,
故答案為:L1>L2;
(3)由電池裝置圖可知,Cu上二氧化碳得電子生成甲烷,則Cu電極上的電極反應為:CO2+8e-+8H+=CH4+2H2O,可向裝置中加入少量的酸作電解質,由于鹽酸易揮發,生成的甲烷中會混有HCl氣體,所以選用硫酸,不用鹽酸
故答案為:CO2+8e-+8H+=CH4+2H2O;硫酸;
(4)反應Ⅰ:2NH3(g)+CO2(g)?NH2COONH4(s)△H1=akJ•mol-1
反應Ⅱ:NH2COONH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1
總反應Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1
依據蓋斯定律計算反應Ⅰ+反應Ⅱ得到:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=akJ•mol-1+72.49kJ•mol-1=-86.98kJ•mol-1
a=-159.47akJ•mol-1,
故答案為:-159.47KJ/mol;
(5)A.若剩余金屬0.5a mol,該金屬可能為鐵或銅,若為鐵,則溶質為硝酸亞鐵,若為銅,則氧化產物可能為硝酸亞鐵和硝酸銅,故A正確;
B.若只有一種氧化產物,說明鐵過量,銅沒有參與反應,反應后溶質為硝酸亞鐵,但是amol鐵不一定完全反應,無法確定a與c的關系,故B錯誤;
C.若只有二種氧化產物,氧化產物可能為硝酸亞鐵和硝酸銅或硝酸銅和硝酸鐵,硝酸可能過量,稀硝酸不一定完全反應,則無法計算被還原的硝酸的量,故C錯誤;
D.若有三種氧化產物,氧化產物為硝酸銅、硝酸鐵和硝酸亞鐵,說明硝酸完全反應,根據反應3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,被還原的硝酸的物質的量為cmol×$\frac{1}{4}$=0.25cmol,故D正確;
故答案為:BC.
點評 本題考查了原電池原理、方程式的書寫、化學平衡常數、平衡移動等,題目涉及的知識點較多,側重于考查學生對基礎知識的綜合應用能力,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl | B. | CH2═CH2+Br2→CH2BrCH2Br | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 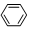 +HNO3$→_{50~60℃}^{濃H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{濃H_{2}SO_{4}}$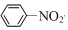 +H2O +H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 利用圖1裝置可定量測定H2O2的分解速率 | |
| B. | 圖2中E1表示使用催化劑后的反應熱 | |
| C. | 圖3表示在平衡體系FeCl3+3KSCN?Fe(SCN)3+3KCl的溶液中溶入少量KCl晶體后化學反應速率隨時間變化的圖象 | |
| D. | 圖4表示弱電解質在水中建立電離平衡的過程 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 4:9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向某溶液中加入AgNO3溶液,可生成白色沉淀,加稀鹽酸沉淀不消失,則可確定該溶液中一定含有Cl-, | |
| B. | 用試管加熱碳酸氫鈉固體時試管口豎直向上 | |
| C. | 實驗室需要800mL0.1mol•L-1NaOH溶液,需要稱取4.0gNaOH進行配制 | |
| D. | 實驗室中可用堿石灰干燥氯氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分液、萃取、蒸餾 | B. | 萃取、蒸餾、分液 | C. | 分液、蒸餾、萃取 | D. | 蒸餾、萃取、分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明礬溶于水產生具有吸附性的膠體粒子,可殺菌消毒 | |
| B. | 氯水可使有色布條褪色,說明氯氣具有漂白性 | |
| C. | 葡萄糖注射液不能產生丁達爾效應現象,不屬于膠體 | |
| D. | 碳素鋼和光導纖維都屬于新型的無機非金屬材料 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com