
【題目】某硫酸廠用以下幾種方法處理SO2尾氣。
(1)活性炭還原法
反應原理:恒溫恒容2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反應進行到不同時間測得各物質的濃度如圖:
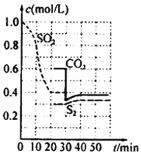
①第一次出現平衡的時間是第__min;
②0~20min反應速率表示為v(SO2)=__;
③30min時,改變某一條件平衡移動,則改變的條件最有可能是__;40min時,平衡常數值為__。
(2)亞硫酸鈉吸收法
常溫下,Na2SO3溶液吸收SO2生成NaHSO3,當吸收至pH=6時,吸收液中相關離子濃度關系一定正確的是__(填序號)。
a.c(Na+)+c(H+)>c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
b.c(Na+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
c.水電離出的c(OH-)=1×10-8mol·L-1
d.c(Na+)>c(SO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
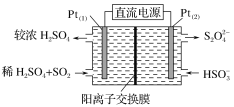
(3)電化學處理法
如圖所示,Pt(1)電極的反應式為__;堿性條件下,用Pt(2)電極排出的S2O![]() 溶液吸收NO2,使其轉化為N2,同時有SO
溶液吸收NO2,使其轉化為N2,同時有SO![]() 生成。若陽極轉移電子6mol,則理論上處理NO2氣體__g。
生成。若陽極轉移電子6mol,則理論上處理NO2氣體__g。
【答案】20 0.03mol/(Lmin) 減小CO2的濃度 0.675 ac SO2+2H2O2e=![]() +4H+ 69
+4H+ 69
【解析】
(1)①各組分濃度不變,反應達到平衡狀態;
②根據反應速率v=![]() 計算;
計算;
③30min時,CO2濃度減小,其他物質濃度不變,改變的條件是減小CO2的濃度;根據平衡常數K=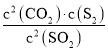 計算;
計算;
(2)常溫下,當吸收至pH=6時,溶液呈酸性;
(3)Pt(1)電極進入SO2,硫酸濃度增大,SO2失電子,作負極;每1molNO2得電子4mol。
(1)①從圖中可看出20min時各組分濃度不變,此時反應達到平衡,故答案為:20;
②0~20min時,SO2濃度變化為1.0mol/L0.4mol/L=0.6mol/L,則反應速率表示為v(SO2)=![]() =0.03mol/(Lmin),故答案為:0.03mol/(Lmin);
=0.03mol/(Lmin),故答案為:0.03mol/(Lmin);
③30min時,CO2濃度減小,其他物質濃度不變,改變的條件是減小CO2的濃度,40min時的平衡常數和20min時相同,20min時,SO2(g)=0.4mol/L,S2(g)=0.3mol/L,CO2(g)=0.6mol/L,則平衡常數K=![]() =0.675,故答案為:減小CO2的濃度;0.675;
=0.675,故答案為:減小CO2的濃度;0.675;
(2)常溫下,當吸收至pH=6時,
a.根據電荷守恒,c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH),所以c(Na+)+c(H+)>c(
)+c(OH),所以c(Na+)+c(H+)>c(![]() )+c(
)+c(![]() )+c(OH),故a正確;
)+c(OH),故a正確;
b.根據物料守恒,當溶質完全為NaHSO3時,c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2SO3),若還存在Na2SO3,則c(Na+)>c(
)+c(H2SO3),若還存在Na2SO3,則c(Na+)>c(![]() )+c(
)+c(![]() )+c(H2SO3),故b錯誤;
)+c(H2SO3),故b錯誤;
c.![]() 電離程度大于水解程度,pH=6,水電離出c(OH)=
電離程度大于水解程度,pH=6,水電離出c(OH)=![]() =l×l08 mol/L,故c正確;
=l×l08 mol/L,故c正確;
d.pH=6,c(OH)<c(H+),故d錯誤;
故答案為:ac;
(3)SO2在Pt(1)電極失電子生成![]() ,電極反應式為SO2+2H2O2e=
,電極反應式為SO2+2H2O2e=![]() +4H+,NO2中N的化合價為+4價,轉化為0價的N2,每1molNO2得電子4mol,若陽極轉移電子6mol,則理論上處理NO2氣體為
+4H+,NO2中N的化合價為+4價,轉化為0價的N2,每1molNO2得電子4mol,若陽極轉移電子6mol,則理論上處理NO2氣體為![]() =1.5mol,m(NO2)=
=1.5mol,m(NO2)=![]() ,
,
故答案為:SO2+2H2O2e=![]() +4H+;69
+4H+;69


科目:高中化學 來源: 題型:
【題目】水的電離平衡曲線如圖所示,下列說法正確的是
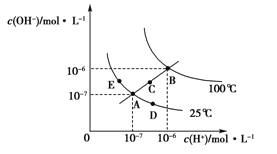
A. 圖中五點KW間的關系:B>C>A=D=E
B. 若從A點到D點,可采用在水中加入少量NaOH的方法
C. 若從A點到C點,可采用溫度不變時在水中加入適量H2SO4 的方法
D. 若處在B點時,將pH=2的硫酸與pH=12的KOH等體積混合后,溶液顯中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種三室微生物燃料電池污水凈化系統原理如下圖所示,圖中含酚廢水中有機物可用C6H6O表示,左、中、右室間分別以離子交換膜分隔。下列說法不正確的是( )

A. 左池的pH值降低
B. 右邊為陰離子交換膜
C. 右池電極的反應式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 當消耗0.1molC6H6O,在標準狀況下將產生0.28mol氮氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】普通鋅錳干電池的簡圖(下圖所示),它是用鋅皮制成的鋅筒作電極兼做容器,中央插一根碳棒,碳棒頂端加一銅帽。在石墨碳棒周圍填滿二氧化錳和炭黑的混合物,并用離子可以通過的長纖維紙包裹作隔膜,隔膜外是用氯化鋅、氯化銨和淀粉等調成糊狀作電解質溶液;該電池工作時的總反應為:Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O
關于鋅錳干電池的下列說法中正確的是
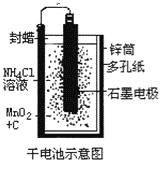
A.當該電池電壓逐漸下降后,利用電解原理能重新充電復原
B.電池負極的電極反應式為:2MnO2+2NH4++2e-= Mn2O3+2NH3+H2O
C.該電池碳棒可用銅棒代替,但是工作電壓會下降
D.外電路中每通過0.1 mol電子,鋅的質量理論上減小6.5g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣中含有CO、NO、NO2、碳氫化合物等多種污染物。回答下列問題:
(1)汽車燃料中不含氮元素,尾氣中所含NO產生的原因是__。
(2)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,則表示辛烷燃燒熱的熱化學方程式為__。
②部分化學鍵鍵能數據如下:

△H2=___kJ·mol-1
(3)1573K時,N2+O2![]() 2NO平衡常數為2.0×10-6,若測得內燃機內平衡混合氣中氮氣、氧氣的物質的量分別為0.2mol、0.001mol,則生成NO的物質的量為__mol,N2的轉化率為__。
2NO平衡常數為2.0×10-6,若測得內燃機內平衡混合氣中氮氣、氧氣的物質的量分別為0.2mol、0.001mol,則生成NO的物質的量為__mol,N2的轉化率為__。
(4)反應NO(g)+CO(g)=N2(g)+CO2(g)的平衡常數為1.68×1060,從熱力學角度看,該反應程度應該很大,實際汽車尾氣中該反應的程度很小,原因是__,要增大汽車尾氣凈化裝置中單位時間內該反應的程度,關鍵是要___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年12月1日國際純粹與應用化學聯合會宣布,將合成的四種新元素命名為113號 (縮寫為Nh)、115號(Mc)、117號(Ts)和118號(Og)。下列說法正確的是
A. 113號元素的氧化物為兩性氧化物
B. 115號元素位于第六周期第VA族
C. 117號元素的某種原子,核內含176個中子,此原子是![]() Ts
Ts
D. 118號元素的原子最外層有8個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酰水楊酸,俗稱阿司匹林(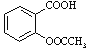 ),是常用的解熱鎮痛藥。實驗室合成流程如下:
),是常用的解熱鎮痛藥。實驗室合成流程如下:
![]()
查閱資料:
阿司匹林:受熱易分解,溶于乙醇、難溶于水
水楊酸(鄰羥基苯甲酸):溶于乙醇、微溶于水
醋酸酐[(CH3CO)2O]:無色透明液體,溶于水形成乙酸
請根據以上信息回答下列問題:
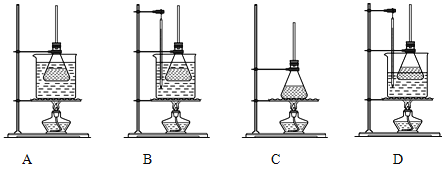
(1)①合成阿司匹林時,下列幾種加熱方式最合適的_____________。
②合成阿司匹林使用的錐形瓶必須干燥的原因是______________。
③如右圖所示裝置,通過抽濾可使粗產品與母液分離。下列說法不正確的是____________。
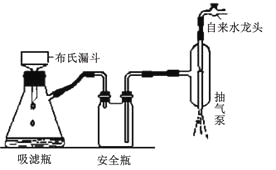
A.抽濾能加快過濾速率,得到相對干燥的沉淀,但顆粒太小的沉淀不能用此裝置
B.當溶液具有強酸性、強氧化性時,可用玻璃砂漏斗代替布氏漏斗
C.抽濾時,當吸濾瓶內液面快到支管口時,先拔掉吸濾瓶上橡皮管,再從吸濾瓶支管口倒出溶液
D.洗滌晶體時,先關閉水龍頭,用洗滌劑緩慢淋洗,再打開水龍頭抽濾
(2)提純粗產物中加入飽和NaHCO3溶液至沒有CO2產生為止,再抽濾。加入飽和NaHCO3溶液的目的是(用化學反應方程式表示)__________________。
(3)另一種改進的提純方法,稱為重結晶提純法。
![]()
①最后步驟中洗滌劑最好選擇_______________。
A.15%的乙醇溶液 B.NaOH溶液 C.冷水 D.濾液
②下列裝置在上述流程中肯定用不到的是_______________。
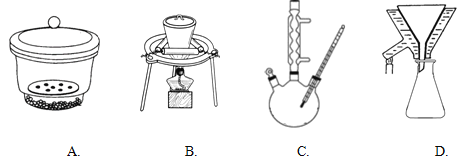
③重結晶時為了獲得較大顆粒的晶體產品,查閱資料得到如下信息:
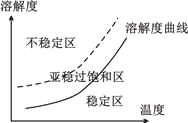
1.不穩定區出現大量微小晶核,產生較多顆粒的小晶體
2.亞穩過飽和區,加入晶種,晶體生長
3.穩定區晶體不可能生長
由信息和已有的知識分析,從溫度較高濃溶液中獲得較大晶體顆粒的操作為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 為原子序數依次增大的五種短周期元素,A是周期表原子半徑最小的元素,
為原子序數依次增大的五種短周期元素,A是周期表原子半徑最小的元素,![]() 同周期且相鄰,C的L層電子數是K層的3倍,E原子的核外電子數是B原子質子數的2倍。下列說法不正確的是( )
同周期且相鄰,C的L層電子數是K層的3倍,E原子的核外電子數是B原子質子數的2倍。下列說法不正確的是( )
A.純凈的E元素的最高價氧化物可用于制造光導纖維
B.![]() 三種元素形成的化合物中一定只含共價鍵
三種元素形成的化合物中一定只含共價鍵
C.由元素![]() 組成的某種化合物可與
組成的某種化合物可與![]() 反應生成
反應生成![]()
D.元素A與![]() 形成的常見化合物中,熱穩定性最好的是AD
形成的常見化合物中,熱穩定性最好的是AD
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃時,密閉容器中X、Y、Z三種氣體的初始濃度和平衡濃度如下表:
物質 | X | Y | Z |
初始濃度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡濃度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列說法錯誤的是:
A. 反應達到平衡時,X的轉化率為50% B. 反應可表示為X+3Y![]() 2Z,其平衡常數為1600 C. 增大壓強使平衡向生成Z的方向移動,平衡常數增大 D. 改變溫度可以改變此反應的平衡常數
2Z,其平衡常數為1600 C. 增大壓強使平衡向生成Z的方向移動,平衡常數增大 D. 改變溫度可以改變此反應的平衡常數
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com