
【題目】工業上電解精煉銅的陽極泥是重要的二次資源,從陽極泥(含銅、銀、金、鉛等單質)中提取金和制備AgCl的工藝如下:

已知:分金液的主要成分為H[AuCl4];分金渣的主要成分為PbSO4和AgCl;分銀液的主要成分為[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
回答下列問題:
(1)“分銅”時,銅單質參與反應的離子方程式為___________;如果溫度過高,銅的浸出率會降低,原因是____________。
(2)“分銅渣”中的成分有Au、Ag、AgCl和__________。
(3)“分金”時,溶解單質金的化學方程式為________;除HC1、NaC1O3可溶解金外,“王水”也可溶解金,“王水”的成分為_____________(寫試劑的名稱)。
(4)從“分金液”中提取金時,氧化劑和還原劑的物質的量之比為_______________。
(5)向“分銀液”中加入適量的H2SO4調到pH=4時“沉銀”,能夠析出AgCl的原因是___________。
(6)AgCl能溶于氨水,發生反應AgCl(s)+2NH3(aq)![]() [Ag(NH3)2](aq))+Cl-(aq),其平衡常數K=2.0×10-3,現用1L某濃度氨水(溶質視為NH3)完全溶解0.1mol AgCl,所需氨水濃度至少為____________mol·L-1(已知
[Ag(NH3)2](aq))+Cl-(aq),其平衡常數K=2.0×10-3,現用1L某濃度氨水(溶質視為NH3)完全溶解0.1mol AgCl,所需氨水濃度至少為____________mol·L-1(已知![]() =2.25)。
=2.25)。
【答案】2H++H2O2+Cu=Cu2++2H2O 溫度過高時,H2O2受熱分解 PbSO4 2Au+8HCl+NaClO3=2H[AuCl4]+NaCl+3H2O 濃硝酸、濃鹽酸 2:3 H2SO4電離出的H+降低了SO32-的濃度,使[Ag(SO3)2]3-![]() Ag++2SO32-平衡正向移動,Ag+和Cl-反應生成AgCl 2.45
Ag++2SO32-平衡正向移動,Ag+和Cl-反應生成AgCl 2.45
【解析】
陽極泥(含銅、銀、金、鉛等單質)加入雙氧水、硫酸和氯化鈉,得到分銅液和分銅渣,這一步目的是除掉銅;分銅渣中加入鹽酸和氯酸鈉得到分金液(H[AuCl4])和分金渣,在分金液中加入還原劑就可以提煉出金;分金渣中加入亞硫酸鈉得到分銀液([Ag(SO3)2]3-)
,在分銀液([Ag(SO3)2]3-)中加入硫酸,根據平衡移動原理提煉出氯化銀。
(1)由于銅排在H后面,不和硫酸反應,所以需加入雙氧水作為氧化劑;溫度過高雙氧水會分解,影響銅的浸出率;
答案: 2H++H2O+Cu=Cu2++2H2O;溫度過高時,H2O2受熱分解;
(2)根據后一步分金渣成分,可推測出“分銅渣”中的成分有Au、Ag、AgCl和PbSO4;
答案:PbSO4 ;
(3)根據已知分金液的主要成分為H[AuCl4],得方程式為2Au+8HCl+NaClO3=2H[AuCl4]+NaCl+3H2O;“王水”的成分為濃硝酸與濃鹽酸體積比1:3混合物;
答案: 2Au+8HCl+NaClO3=2H[AuCl4]+NaCl+3H2O;濃硝酸、濃鹽酸;
(4)氧化劑(H[AuCl4])中Au從正三價降到零價和還原劑(Na2SO3)中S從正四價升高到正六價,根據化合價升降相等(或得失電子數相等),可得物質的量之比為2:3;
答案: 2:3;
(5)根據化學平衡移動原理可知,H2SO4電離出的H+與SO32-,降低了SO32-的濃度,使[Ag(SO3)2]3![]() -Ag++2SO32-平衡正向移動,Ag+和Cl-反應生成AgCl,
-Ag++2SO32-平衡正向移動,Ag+和Cl-反應生成AgCl,
答案: H2SO4電離出的H+與SO32-,降低了SO32-的濃度,使[Ag(SO3)2]3![]() -Ag++2SO32-平衡正向移動,Ag+和Cl-反應生成AgCl;
-Ag++2SO32-平衡正向移動,Ag+和Cl-反應生成AgCl;
(6)根據方程式可知完全反應0.1mol AgCl,需要NH3:0.2mol,生成[Ag(NH3)2](aq))和Cl-(aq)各0.1mol,根據平衡常數計算平衡后應該還剩余的NH3,設剩余NH3 xmol,AgCl(s)+2NH3(aq)![]() [Ag(NH3)2](aq))+Cl-(aq),由于容器體積為1L,利用物質的量代替濃度計算平衡常數K,K=2.0×10-3=
[Ag(NH3)2](aq))+Cl-(aq),由于容器體積為1L,利用物質的量代替濃度計算平衡常數K,K=2.0×10-3=![]() ,得出x=
,得出x=![]() =2.25,所以共需要NH3:0.2+2.25=2.45mol;
=2.25,所以共需要NH3:0.2+2.25=2.45mol;
答案:2.45。


科目:高中化學 來源: 題型:
【題目】實驗測得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH隨溫度變化的曲線如圖所示。下列說法正確的是

A. 隨溫度升高,純水中c(H+)>c(OH)
B. 隨溫度升高,CH3COONa溶液的c(OH)減小
C. 隨溫度升高,CuSO4溶液的pH變化是Kw改變與水解平衡移動共同作用的結果
D. 隨溫度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因為CH3COO、Cu2+水解平衡移動方向不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2的資源化利用能有效減少CO2排放,充分利用碳資源。
(1)CaO可在較高溫度下捕集CO2,在更高溫度下將捕集的CO2釋放利用。CaC2O4·H2O熱分解可制備CaO,CaC2O4·H2O加熱升溫過程中固體的質量變化見下圖。

①寫出400~600 ℃范圍內分解反應的化學方程式:________。
②與CaCO3熱分解制備的CaO相比,CaC2O4·H2O熱分解制備的CaO具有更好的CO2捕集性能,其原因是________。
(2)電解法轉化CO2可實現CO2資源化利用。電解CO2制HCOOH的原理示意圖如下。

①寫出陰極CO2還原為HCOO的電極反應式:________。
②電解一段時間后,陽極區的KHCO3溶液濃度降低,其原因是________。
(3)CO2催化加氫合成二甲醚是一種CO2轉化方法,其過程中主要發生下列反應:
反應Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反應Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒壓、CO2和H2的起始量一定的條件下,CO2平衡轉化率和平衡時CH3OCH3的選擇性隨溫度的變化如圖。其中:

CH3OCH3的選擇性=![]() ×100%
×100%
①溫度高于300 ℃,CO2平衡轉化率隨溫度升高而上升的原因是________。
②220 ℃時,在催化劑作用下CO2與H2反應一段時間后,測得CH3OCH3的選擇性為48%(圖中A點)。不改變反應時間和溫度,一定能提高CH3OCH3選擇性的措施有________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某有機物A的紅外光譜和核磁共振氫譜如下圖所示,下列說法中錯誤的有( )


A. 由紅外光譜可知,該有機物中至少含有三種不同的化學鍵
B. 由核磁共振氫譜可知,該有機物分子中有三種不同化學環境的氫原子
C. 若A的化學式為C2H6O,則其結構簡式為CH3—O—CH3
D. 僅由其核磁共振氫譜無法得知其分子中的氫原子總數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備硝基苯的方法是將苯與濃硫酸和濃硝酸的混合液加熱到 50~60℃反應。已知苯與硝基苯的基本物理性質如下表所示:
熔點 | 沸點 | 狀態 | |
苯 | 5.51℃ | 80.1℃ | 無色液體 |
硝基苯 | 5.7℃ | 210.9℃ | 油狀液體 |
(1)(在大試管中)配制濃硫酸和濃硝酸的混合酸的操作方法是____________________。
(2)分離硝基苯和水的混合物的方法是________;分離硝基苯和苯的方法是_________。
(3)某同學用如圖裝置制取硝基苯:
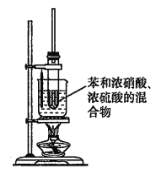
①用水浴加熱的優點是________________________________________________________;
②被水浴加熱的試管口部都要帶一長導管,其作用是______________________________。
(4)寫出此反應的化學方程式_________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 已知冰的熔化熱為6.0kJ·mol-1,冰中氫鍵鍵能為20kJmol-1,假設每摩爾冰中有2mol氫鍵,且熔化熱完全用于打破冰的氫鍵,則最多只能破壞冰中15%的氫鍵
B. 已知一定溫度下,醋酸溶液的物質的量濃度為c,電離度為a,Ka=(ca)2/c(1-a)。若加水稀釋,,則CH3COOH![]() CH3COO-+H+向右移動,a增大,Ka不變
CH3COO-+H+向右移動,a增大,Ka不變
C. 甲烷的標準燃燒熱為-890.3kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,將0.5molN2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈣(CaO2)是一種白色晶體,無臭無味,能潮解,難溶于水,可與水緩慢反應;不溶于醇類、乙醚等,易與酸反應,常用作殺菌劑、防腐劑等。通常利用CaCl2在堿性條件下與H2O2反應制得。
某化學興趣小組在實驗室制備CaO2的實驗方案和裝置示意圖如下:


請回答下列問題:
(1)三頸燒瓶中發生的主要反應的化學方程式為________________;
(2)支管B的作用是__________;加入氨水的作用是________________;
(3)步驟③中洗滌CaO2·8H2O的液體X的最佳選擇是____________;
A.無水乙醇 B.濃鹽酸 C.水 D.CaCl2溶液
(4)過氧化鈣可用于長途運輸魚苗,這體現了過氧化鈣_____________的性質;
A.可緩慢供氧 B.能吸收魚苗呼出的CO2氣體C.能潮解 D.可抑菌
(5)已知CaO2在350℃時能迅速分解,生成CaO和O2。該小組采用如圖所示的裝置測定剛才制備的產品中CaO2的純度(設雜質不分解產生氣體)

①檢查該裝置氣密性的方法是:____________________;
②使用分析天平準確稱取0.5000g樣品,置于試管中加熱使其完全分解,收集到 33.60mL(已換算為標準狀況)氣體,則產品中過氧化鈣的質量分數為_________(保留4位有效數字);
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在甲、乙兩燒杯中分別加入含等物質的量的硫酸溶液,再向甲燒杯中加入m g鎂,向乙燒杯中加入m g鋅。完全反應后,有一燒杯中仍有金屬未溶解,則每一燒杯中反應前H2SO4的物質的量X的值是( )
A.m/24<X<m/65B.X≥m/24
C.m/24>X≥m/65D.X≤m/65
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有前四周期A,B,C,D,E、X六種元素,已知B,C,D,E、A五種非金屬元素原子半徑依次減小,其中B的s能級上電子總數等于p能級上電子總數的2倍.X原子的M能層上有4個未成對電子.請回答下列問題:
(1)寫出C,D,E三種原子第一電離能由大到小的順序為__。
(2)A原子與B,C,D原子形成最簡單化合物的穩定性由強到弱的順序為__,根據價層電子對互斥理論預測BA2D的分子構型為__。
(3)某藍色晶體,其結構特點是X2+、X3+離子分別占據立方體互不相鄰的頂點,而立方體的每條棱上均有一個BC﹣.與A同族且相差兩個周期的元素R的離子位于立方體的恰當位置上,根據其結構特點可知該晶體的化學式為____(用最簡正整數表示)。
(4)科學家通過X射線探明,KCl、MgO、CaO、TiN的晶體結構與NaCl的晶體結構相似(如右圖所示),其中3種離子晶體的晶格能數據如下表:

根據表格中的數據:判斷KCl、MgO、TiN 三種離子晶體熔點從高到低的順序是__,MgO晶體中一個Mg2+周圍和它最鄰近且等距離的O2﹣有__個。
(5)研究物質磁性表明:金屬陽離子含未成對電子越多,則磁性越大,磁記錄性能越好,離子型氧化物V2O5和Cr2O3中,適合作錄音帶磁粉原料的是__。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com