
氮及其化合物在工農業生產中具有重要作用。
(1)某小組進行工業合成氨N2(g)+3H2(g) 2NH3(g) △H<0的模擬研究,在1L密閉容器中,分別加入0.1mol N2和0.3mol H2。實驗①、②、③中c(N2)隨時間(t)的變化如圖所示。
2NH3(g) △H<0的模擬研究,在1L密閉容器中,分別加入0.1mol N2和0.3mol H2。實驗①、②、③中c(N2)隨時間(t)的變化如圖所示。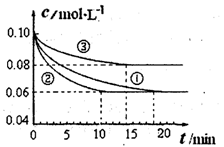
實驗②從開始到達到平衡狀態的過程中,用H2表示的平均反應速率為 。與實驗①相比,.實驗②所采用的實驗條件可能為 (填字母),實驗③所采用的實驗條件可能為 (填字母)。
a.增大壓強b.減小壓強c.升高溫度d.降低溫度e.使用催化劑
(2)NH3可用于處理廢氣中的氮氧化物,其反應原理為2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) △H<0欲提高廢氣中氮氧化物的轉化率,可采取的措施是 (填字母)
2N2(g)+3H2O(g) △H<0欲提高廢氣中氮氧化物的轉化率,可采取的措施是 (填字母)
a.升高溫度 b.增大壓強 c,增大NH3的濃度
(3)NCl3遇水發生水解反應,生成NH3的同時得到 (填化學式)。ClO2是廣譜高效消毒劑,制備原理為NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若轉移1mol電子,則制取ClO2的質量為 。
(4)25℃時,將amol·L-1的氨水與bmol·L-1鹽酸等體積混合,反應后溶液恰好顯中性,則a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的電離平衡常數為 。
(12分)(1)0.012mol/(L?min)(2分) e(1分) c(1分) (2)c(2分)
(3)HClO(1分) 67.5(2分) (4)>(1分) 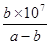 mol/L(2分)
mol/L(2分)
解析試題分析:(1)根據圖像可知,實驗②中反應進行到10min到達平衡狀態,平衡時氮氣的物質的量濃度減少了=0.1mol/L-0.06mol/L=0.04mol/L。根據方程式可知,氫氣的濃度變化量△c(H2)=3△c(N2)=3×0.04mol/L=0.12mol/L,所以υ(H2)=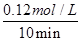 =0.012mol/(L?min);根據圖像可知,與實驗①相比,實驗②到達平衡所用時間比較短,反應速率較快,但平衡時氮氣的濃度不變,即改變條件平衡不移動。由于該反應正反應是氣體體積減小的反應,故實驗②的條件應是使用了催化劑,答案選e;根據圖像可知,與實驗①相比,實驗③到達平衡所用時間也比較短,反應速率較快,但平衡時氮氣的濃度增大,這說明改變體積平衡向逆反應移動。由于該反應正反應是體積減小的放熱反應,因此實驗③所采用的實驗條件是升高溫度,答案選c。
=0.012mol/(L?min);根據圖像可知,與實驗①相比,實驗②到達平衡所用時間比較短,反應速率較快,但平衡時氮氣的濃度不變,即改變條件平衡不移動。由于該反應正反應是氣體體積減小的反應,故實驗②的條件應是使用了催化劑,答案選e;根據圖像可知,與實驗①相比,實驗③到達平衡所用時間也比較短,反應速率較快,但平衡時氮氣的濃度增大,這說明改變體積平衡向逆反應移動。由于該反應正反應是體積減小的放熱反應,因此實驗③所采用的實驗條件是升高溫度,答案選c。
(2)提高廢氣中氮氧化物的轉化率,應改變條件使平衡向正反應移動,則:
a.該反應正反應是放熱反應,升高溫度,平衡向逆反應移動,氮氧化物的轉化率降低,故a錯誤;
b.該反應正反應是體積增大的反應,增大壓強,平衡向逆反應移動,氮氧化物的轉化率降低,故b錯誤;c.增大NH3的濃度,平衡向正反應移動,氮氧化物的轉化率增大,故c正確,答案選c。
(3)NCl3遇水發生水解反應生成NH3,這說明NCl3分子中負價原子結合水電離的H+,因此正價原子結合水電離的OH-,所以生成NH3的同時還得到HClO;反應中只有氯元素的化合價發生變化,氯元 素由NCl3中+1降低為Cl-中-1價,得到電子;由ClO2-中+3價升高為ClO2中+4價,失去1個電子,即每生成1molClO2,反應中就轉移1mol電子。所以當轉移1mol電子時,生成ClO2的物質的量為1mol,質量為1mol×67.5g/mol=67.5g。
(4)溶液顯中性,所以c(H+)=c(OH-)。根據溶液的電荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+ c(OH-),因此c(NH4+)=c(Cl-)。氯化銨是強酸弱堿鹽,NH4+水解,其水溶液呈酸性,因此要使氯化銨溶液呈中性,則氨水應稍微過量。因為鹽酸和氨水的體積相等,則氨水的物質的量濃度大于鹽酸,即a>b;溶液中c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=0.5bmol/L,所以c(NH3?H2O)=0.5amol/L-0.5bmol/L。電離常數只與溫度有關,則此時NH3?H2O的電離常數Kb=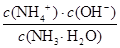 =
=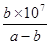 mol/L.。
mol/L.。
考點:考查反應速率的計算、外界條件對反應速率和平衡狀態的影響;氧化還原反應的有關計算;溶液酸堿性的判斷以及電離常數的計算等


 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:填空題
(1)在密閉容器中進行下列反應:M(g) + N(g)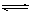 R(g) + 2L(?),此反應規律符合下圖圖像。
R(g) + 2L(?),此反應規律符合下圖圖像。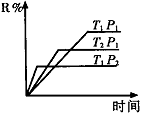
①T1 T2 ,正反應的△H 0。(填“>”、“<”或“=”,下同)。
②P1 P2 , L為 。(填“固”或“液”或“氣”態)。
(2)合成氨的原理為:N2(g)+3H2(g)  2NH3(g)
2NH3(g) 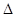 H=-92.4 kJ/mol,該反應的能量變化如圖所示。
H=-92.4 kJ/mol,該反應的能量變化如圖所示。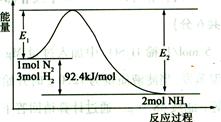
①在反應體系中加入催化劑,反應速率增大,E2的變化是 (填“增大”、“減小”或“不變”)。②若在一密閉容器中加入1molN2和3molH2,在一定條件下充分反應,放出的熱量 92.4kJ.(填“>”、“<”或“=”)。
③將1 mol N2和3 mol H2充入體積不變的密閉容器中,在一定條件下達到平衡,此時欲提高該容器中H2的轉化率,下列措施可行的是 (填字母)。
| A.向容器中按原比例再充入原料氣 | B.向容器中再充入一定量H2 |
| C.改變反應的催化劑 | D.液化生成物分離出氨 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)工業制硫酸時,利用接觸氧化反應將SO2轉化為SO3是一個關鍵的步驟。
(1)在接觸室中2SO2(g)+O2(g)  2SO3(g)達到平衡狀態的標志是______。
2SO3(g)達到平衡狀態的標志是______。
| A.υ(O2)正=2υ(SO2)逆 |
| B.容器中氣體的總質量不隨時間而變化 |
| C.容器中氣體的顏色不隨時間而變化 |
| D.容器中氣體的壓強不隨時間而變化 |
 2SO3(g) ΔH<0。下列圖像中不正確的是______ (填字母序號)。
2SO3(g) ΔH<0。下列圖像中不正確的是______ (填字母序號)。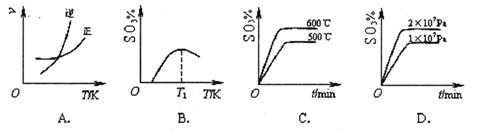
 O2(g)
O2(g)  SO3(g) ΔH=-98KJ/mol
SO3(g) ΔH=-98KJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:填空題
2012年冬季,我國城市空氣污染狀況受到人們的強烈關注,其中NOx、CO、SO2是主要污染性氣體。
I.汽車內燃機工作時發生的反應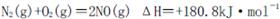 是導致汽車尾 氣中含有NO的重要原因之一。
是導致汽車尾 氣中含有NO的重要原因之一。
(1)有人欲選用合適的催化劑,使反應2NO(g)=N2(g)+O2(g)能較快進行以達到除去NO的目的。你認為該反應能否自發進行 (填“能”或“不能”)。
(2)利用催化技術可將汽車尾氣中的NO氣體轉化成無毒氣體,相關反應的平衡常數可表示為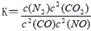 ,此反應為放熱反應。在一定溫度下,10L某密閉容器中發生上述反應,各物質的物質的量的變化情況如下表
,此反應為放熱反應。在一定溫度下,10L某密閉容器中發生上述反應,各物質的物質的量的變化情況如下表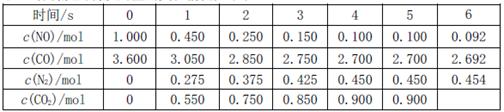
①根據土表數據計算0~4s間用NO表示的平均速率v(NO)= ;達到化學平衡時兩種反應物的轉化率是否相等 (填“相等”或“不相等”)。
②在5~6s時,若K增大,5s后正反應速率 (填“增大”或“減小”)
③在5~6s時,若K不變,以上各物質的物質的量變化原因可能是 。
A.選用更有效的催化劑 B.縮小容器的體積
C.降低CO2濃度 D.升高溫度
II為探究硫在氧氣中燃燒的產物里是否有SO3,某化學興趣小組在絕熱環境下進行了定量實驗探究。探究實驗的相關數據如下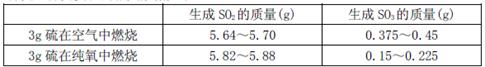
(3)對數據進行分析可知,等質量的硫在純氧中燃燒產生的SO3比在空氣中燃燒產生的SO3 (填“多”或“少”),原因可能是 。
A.純氧中氧氣濃度高,有利于化學平衡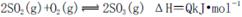 向右移動
向右移動
B.化學反應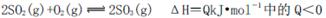
C.純氧中氧氣濃度高,單位時間內發熱量大,致使反應體系的溫度較高,不利于化學平衡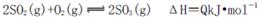 向右移動
向右移動
D.3g硫在純氧中燃燒比3g硫在空氣中燃燒放出的熱量多,不利于化學平衡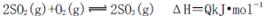 向右移動
向右移動
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某溫度時,在3L密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示。由圖中數據分析:
(1)該反應的化學方程式: ;
(2)反應開始至2min末,X的反應速率為 ;
(3)該反應是由 開始反應的。(?正反應?逆反應?正逆反應同時。)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一固定容積為2 L的密閉容器中加入2 molA和3 molB,保持溫度為30℃,在
催化劑存在的條件下進行下列反應:2A(g)+3B(g)  3C(g),2分鐘達到平衡,生成1.5 mol
3C(g),2分鐘達到平衡,生成1.5 mol
C,此時,平衡混合氣中C的體積分數為ω1;若將溫度升高到70℃后,其他條件均不變,當
反應重新達到平衡時,C的物質的量為2.1 mol,體積分數為ω2,請回答下列問題,
(1)該反應在30℃時平衡常數K1= ,焓變△H 0(填“>”、“<”或“=”)。
(2)該反應在30℃時平衡混合氣中C的體積分數為ω1= ;從反應開始到達到化學平衡狀態時v(A)=____________mol/(L·min)
(3)該反應在70℃時平衡常數為K2,則 K1 K2(填“>”、“=”或“<”)
(4)70℃時,若保持溫度不變,在2 L的密閉容器中加入4 molA和6 molB,當反應重新達到平衡時,C的體積分數為ω3,則ω3 ω2 (填“>”、“<”或“="”" )。
(5)可以判斷2A(g)+3B(g)  3C(g) 反應已經達到平衡的是( )
3C(g) 反應已經達到平衡的是( )
A.2v(B)=3v(A)
B.密閉容器中總壓強不變
C.密閉容器中混合氣體的密度不變
D.混合氣體的平均相對分子質量不再改變
E.n(A)∶n(B)∶n(C)=2∶3∶3
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在下列事實中,什么因素影響了化學反應速率?
①天的食品易霉變,冬天就不易發生該現象 。
②熔化的氯酸鉀放出氣泡較慢,撒入少量二氧化錳很快產生氣體 。
③工業上常將固體燃料粉碎,以提高燃燒效率 。
④同體積、同濃度的鹽酸與同樣大小的鋅條和鎂條反應,產生氣體前慢后快 。
⑤同體積、同濃度的硫酸和鹽酸與同樣大小質量相等的鋅粒反應,產生氣體前者快 。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(15分)請回答下列問題:
(1)分別用濃、稀硝酸溶解等量的兩份銅粉,消耗硝酸的物質的量較少的是_________硝酸(填“濃”或“稀”),相應的離子方程式是_____________.
(2) 800 時,在2L的恒容密閉容器中充入2molNO和1molO2發生反應,2NO(g)+O2(g)
時,在2L的恒容密閉容器中充入2molNO和1molO2發生反應,2NO(g)+O2(g) 2NO2(g),經5min達到平衡,測得c(NO)="0.5" mol/L,并放熱QkJ。5min內 v(O2)=___________。
2NO2(g),經5min達到平衡,測得c(NO)="0.5" mol/L,并放熱QkJ。5min內 v(O2)=___________。
②該條件下,2NO(g)+O2(g) 2NO2(g)的△H= 。
2NO2(g)的△H= 。
③若向平衡混合物中再充入NO、NO2各1mol,此時v正 v逆(填“>”、“=”或“<”)。
④若向平衡混合物中僅充入lmolNO2,平衡向_______(填“正向”、“逆向”或“不”)移
動。達新平衡時,NO2的體積分數________(填“增大”、“減小”或“不變”)。
(3)染料工業排放的廢水中含有大量有毒的NO2-,可以在強堿性條件下加入鋁粉除去(反應過程中無氣態產物生成。加熱反應后的溶液有能使濕潤的紅色石蕊試紙變藍的氣體逸出)。請寫出該反應的離子方程式________
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
(14分)為有效控制霧霾,各地積極采取措施改善大氣質量,研究并有效控制空氣中的氮氧化物、碳氧化物和硫氧化物含量顯得尤為重要。
(1)汽車內燃機工作時會引起N2和O2的反應:N2 + O2 2NO,是導致汽車尾氣中含有NO的原因之一。
2NO,是導致汽車尾氣中含有NO的原因之一。
①在T1、T2溫度下,一定量的NO發生分解反應時N2的體積分數隨時間變化如右圖所示,根據圖像判斷反應N2(g) + O2(g) 2NO(g)的△H________0(填“>”或“<”)。
2NO(g)的△H________0(填“>”或“<”)。
②在T3溫度下,向2L密閉容器中充入10molN2與5mo1O2,50秒后達到平衡,測得NO的物質的量為2mol,則該反應的速率υ(N2)=___________________。該溫度下,若開始時向上述容器中充入N2與O2均為1 mol,則達到平衡后N2的轉化率為____________。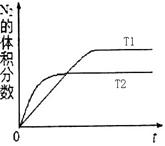
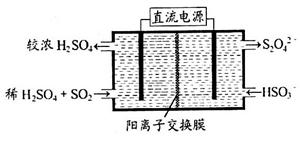
(2)利用右圖所示裝置(電極均為惰性電極)可吸收SO2,用陰極排出的溶液可吸收NO2。
①陽極的電極反應式為_____________________。
②在堿性條件下,用陰極排出的溶液吸收NO2,使其轉化為無害氣體,同時有SO32-生成。該反應中氧化劑與還原劑的物質的量之比為________。
(3)一定條件下可用甲醇與CO反應生成醋酸消除CO污染。常溫下,將a mol/L的醋酸與b mol/L
Ba(OH)2溶液等體積混合,充分反應后,溶液中存在2c(Ba2+)=c(CH3COO-),則該混合溶液中醋酸的電離常數Ka=______________________(用含a和b的代數式表示)。
(4)引起霧霾的PM2.5微細粒子包含(NH4)2SO4、NH4NO3、有機顆粒物及揚塵等,任寫一種與SO42-互為等電子體的分子 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com