
(12分) 最新研究發現,用隔膜電解法處理高濃度乙醛廢水具有工藝流程簡單、電耗較低等優點,其原理是使乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸,總反應為:2CH3CHO
+ H2O CH3CH2OH
+ CH3COOH
CH3CH2OH
+ CH3COOH
實驗室中,以一定濃度的乙醛—Na2SO4溶液為電解質溶液,
模擬乙醛廢水的處理過程,其裝置示意圖如右圖所示。
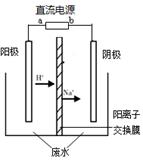
(1)若以甲烷燃料電池為直流電源,則燃料電池中b極應通入 (填化學式)氣體。
(2)電解過程中,兩極除分別生成乙酸和乙醇外,均產生無色氣體。電極反應如下:
陽極:① 4OH- - 4e- == O2↑+ 2H2O
②
陰極:①
② CH3CHO + 2e- + 2H2O == CH3CH2OH + 2OH-
(3)電解過程中,陰極區Na2SO4的物質的量 (填“增大”、“減小”或“不變”)。
(4)已知:乙醛、乙醇的沸點分別為20.8℃、78.4℃。從電解后陰極區的溶液中分離出乙醇粗品的方法是 。
(5)在實際工藝處理中,陰極區乙醛的去除率可達60%。若在兩極區分別注入1 m3乙醛的含量為3000 mg/L的廢水,可得到乙醇 kg(計算結果保留小數點后1位)。
(1)CH4(2)CH3CHO -2e- + H2O == CH3COOH + 2H+ 4H+ + 4e- == 2H2↑或4H2O + 4e- == 2H2↑+ 4OH- (寫成“2H+ + 2e- == H2↑”不扣分)(3)不變
(4)蒸餾(5)1.9
【解析】(1)電解池中和電源負極相連的是陰極,所以b是負極,a是正極。原電池中負極失去電子,所以甲烷在負極通入。
(2)電解池中陽極失去電子,所以陽極除OH-放電以外,乙醛也失去電子,被氧化生成乙酸,方程式為CH3CHO -2e- + H2O == CH3COOH + 2H+;陰極得到電子,所以陰極除乙醛也得到電子,被還原生成乙醇外,氫離子得到電子,方程式為4H+ + 4e- == 2H2↑。
(3)根據(2)可知,硫酸鈉不參與反應,所以硫酸鈉的物質的量不變。
(4)根據乙醇和乙醛的沸點相差較大可知,要分離二者,應該采用蒸餾。
(5)根據電極反應式可知,陰極區生成的乙醇是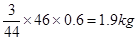 。
。


科目:高中化學 來源: 題型:閱讀理解
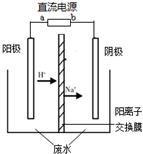 (2012?海淀區二模)最新研究發現,用隔膜電解法處理高濃度乙醛廢水具有工藝流程簡單、電耗較低等優點,其原理是使乙醛分別在陰、電解陽極發生反應,轉化為乙醇和乙酸,總反應為:2CH3CHO+H2O═CH3CH2OH+CH3COOH實驗室中,以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置示意圖如圖所示.
(2012?海淀區二模)最新研究發現,用隔膜電解法處理高濃度乙醛廢水具有工藝流程簡單、電耗較低等優點,其原理是使乙醛分別在陰、電解陽極發生反應,轉化為乙醇和乙酸,總反應為:2CH3CHO+H2O═CH3CH2OH+CH3COOH實驗室中,以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置示意圖如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:

|

| 通電 |
查看答案和解析>>
科目:高中化學 來源: 題型:
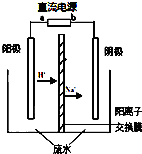 最新研究發現,用隔膜電解法處理高濃度乙醛廢水具有工藝流程簡單、電耗較低等優點,其原理是使乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸,總反應為:2CH3CHO+H2O→CH3CH2OH+CH3COOH實驗室中,以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置示意圖如圖所示.
最新研究發現,用隔膜電解法處理高濃度乙醛廢水具有工藝流程簡單、電耗較低等優點,其原理是使乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸,總反應為:2CH3CHO+H2O→CH3CH2OH+CH3COOH實驗室中,以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置示意圖如圖所示.查看答案和解析>>
科目:高中化學 來源:2013屆江西省九江市第一中學高三入學考試化學試卷(帶解析) 題型:填空題
(12分)最新研究發現,用隔膜電解法處理高濃度乙醛廢水具有工藝流程簡單、電耗較低等優點,其原理是使乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸,總反應為:2CH3CHO + H2O CH3CH2OH + CH3COOH
CH3CH2OH + CH3COOH
實驗室中,以一定濃度的乙醛—Na2SO4溶液為電解質溶液,
模擬乙醛廢水的處理過程,其裝置示意圖如右圖所示。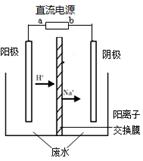
(1)若以甲烷燃料電池為直流電源,則燃料電池中b極應通入 (填化學式)氣體。
(2)電解過程中,兩極除分別生成乙酸和乙醇外,均產生無色氣體。電極反應如下:
陽極:① 4OH- - 4e- ="=" O2↑+ 2H2O
②
陰極:①
② CH3CHO + 2e- + 2H2O ="=" CH3CH2OH + 2OH-
(3)電解過程中,陰極區Na2SO4的物質的量 (填“增大”、“減小”或“不變”)。
(4)已知:乙醛、乙醇的沸點分別為20.8℃、78.4℃。從電解后陰極區的溶液中分離出乙醇粗品的方法是 。
(5)在實際工藝處理中,陰極區乙醛的去除率可達60%。若在兩極區分別注入1 m3乙醛的含量為3000 mg/L的廢水,可得到乙醇 kg(計算結果保留小數點后1位)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com