
【題目】下列實驗不能達到實驗目的或者實驗操作不正確的是
A. 定容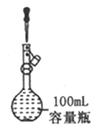
B. 比較硫、碳、硅三種元素
C. 處理尾氣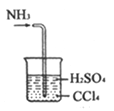
D. 測定黃銅(Cu、Zn素的非金屬性強弱合金)中Zn的含量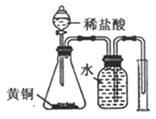
【答案】A
【解析】A.定容時,當液面距離刻度線下1~2cm處,改用膠頭滴管滴加蒸餾水,圖中液面距離刻度線遠大于2cm,應該用玻璃棒引流注入蒸餾水,故A錯誤;B.若錐形瓶中生成氣體,說明硫酸的酸性比碳酸強,燒杯中生成白色沉淀,說明碳酸的酸性比硅酸強,最高價氧化物對應水化物酸性越強,則對應元素的非金屬性越強,因此比較硫、碳、硅非金屬性強弱的實驗方案合理,故B正確;C.氨氣易溶于硫酸,難溶于四氯化碳,四氯化碳的密度比硫酸溶液大,導管口伸入下層液體可以防止倒吸,逸出的氨氣被稀硫酸完全吸收生成銨鹽,故C正確;D.鋅是氫前金屬,銅是氫后金屬,前者與稀鹽酸發生置換反應,生成的氫氣難溶于水,水還能除去氫氣中混有的氯化氫,排水量氣法收集氫氣,根據氫氣的體積可以計算完全反應的鋅的質量,進而可以求黃銅中鋅的含量,故D正確;故選A。


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
【題目】下圖為硬脂酸甘油酯在堿性條件下水解的裝置圖,

進行皂化反應時的步驟如下:
(1)在圓底燒瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氫氧化鈉、5 mL水和10 mL酒精,加入酒精的作用是____________________。
(2)隔著石棉網給反應混合物加熱約10 min,皂化反應基本完成,所得的混合物為________(填“懸濁液”、“乳濁液”、“溶液”或“膠體”)。
(3)向所得混合物中加入________,靜置一段時間后,溶液分為上下兩層,肥皂在________層,這個操作稱為________。
(4)圖中長玻璃導管的作用為__________________________________。
(5)寫出該反應的化學方程式:________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯在飲用水處理中常用作殺菌劑,且HClO的殺菌能力比ClO-強。25℃時氯氣-氯水體系中存在以下平衡關系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO + H++Cl-K2=10-3.4
HClO + H++Cl-K2=10-3.4
HClO![]() H++ ClO-Ka=?
H++ ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分別在三者中所占分數(α)隨pH變化的關系如圖所示。下列表述正確的是( )

A. Cl2(g)+ H2O![]() 2H++ ClO-+ Cl-K=10-10.9
2H++ ClO-+ Cl-K=10-10.9
B. 在氯處理水體系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C. 用氯處理飲用水時,pH=7.5時殺菌效果比pH=6.5時好
D. 氯處理飲用水時,在夏季的殺菌效果比在冬季差
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】釩和鎳及其化合物是重要的催化劑和合金材料。
(1)基態V原子的價層電子排布式為________,其中排布時能量最高的電子所占據能級的原子軌道有________個仲展方向。
(2)VO2+與 可形成配合物。
可形成配合物。 中,三種非金屬原子的第一電離能由大到小的順序為________(用元素符號表示);C原子的雜化軌道類型為_________。
中,三種非金屬原子的第一電離能由大到小的順序為________(用元素符號表示);C原子的雜化軌道類型為_________。
(3)鎳形成的[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子中N原子的價層電子對數目為______。與CN-互為等電子體的一種分子的化學式為__________。
(4)La-Ni合金是重要的儲氫材料,儲氫后的晶胞如圖所示。

①合金中,1個La原子周圍距離最近且相等的La原子數目為_______。
②含有1mol Ni原子的合金中儲存H2的物質的量為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質間的轉化通過—步反應不能實現的是
A.CO2→Na2CO3 B.FeCl3→FeCl2
C.H2SiO3→Na2SiO3 D.S→SO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列說法正確的是
A. ①和②產物的陰陽離子個數比不相等
B. ①和②生成等物質的量的產物,轉移電子數不同
C. 常溫下Na與足量O2反應生成Na2O,隨溫度升高生成Na2O的速率逐漸加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】開發氫能是實現社會可持續發展的需要。硫鐵礦(FeS2)燃燒產生的SO2通過下列碘循環工藝過程既能制H2SO4,又能制H2。

請回答下列問題:
(1)已知1gFeS2完全燃燒放出7.1kJ熱量,FeS2燃燒反應的熱化學方程式為______________。
(2)該循環工藝過程的總反應方程式為_____________。
(3)用化學平衡移動的原理分析,在HI分解反應中使用膜反應器分離出H2的目的是____________。
(4)用吸收H2后的稀土儲氫合金作為電池負極材料(用MH)表示),NiO(OH)作為電池正極材料,KOH溶液作為電解質溶液,可制得高容量,長壽命的鎳氫電池。電池充放電時的總反應為:

①電池放電時,負極的電極反應式為____________。
②充電完成時,Ni(OH)2全部轉化為NiO(OH)。若繼續充電將在一個電極產生O2,O2擴散到另一個電極發生電極反應被消耗,從而避免產生的氣體引起電池爆炸,此時,陰極的電極反應式為______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳的回收利用是環保領域研究熱點。
(1)在太陽能的作用下,以CO2為原料制取炭黑的流程如右圖所示。總反應的化學方程式為 。

(2)有一種用CO2生產甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。已知298K和101KPa條件下:
CH3OH+H2O。已知298K和101KPa條件下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
則CH3OH(l)的標準燃燒熱△H=___________________。
(3)CO2經過催化氫化合成低碳烯烴,合成乙烯反應為
2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密閉容器中充入2 mol CO2和n mol H2,在一定條件下發生反應,CO2的轉化率與溫度、投料比![]() 的關系如右圖所示。
的關系如右圖所示。

①平衡常數KA KB
②T K時,某密閉容器發生上述反應,反應進行到不同時間測得各物質的濃度如下:
時間(min) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min間只改變了某一條件,根據上表中的數據判斷改變的條件可能是
A.通入一定量H2B.通入一定量CH2=CH2
C.加入合適催化劑 D.縮小容器體積
畫出CH2=CH2的濃度隨反應時間的變化曲線。

(4)在催化劑M的作用下,CO2和H2同時發生下列兩個反應
A.2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0

上圖是乙烯在相同時間內,不同溫度下的產率,則高于460℃時乙烯產率降低的原因不可能是
A.催化劑M的活性降低 B.A反應的平衡常數變大
C.生成甲醚的量增加 D.B反應的活化能增大
(5)Na2CO3溶液也通常用來捕獲CO2。常溫下,H2CO3的第一步、第二步電離常數分別約為Ka1=4×10-7 ,Ka2=5×10-11,則0.5mol·L-1的Na2CO3溶液的pH等于 (不考慮第二步水解和H2O的電離)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳的捕集、利用是我國能源領域的一個重要戰略方向。

(1)科學家提出由CO2制取C的太陽能工藝如上圖所示。
①若“重整系統”發生的反應中![]() =6,則FexOy的化學式為________。
=6,則FexOy的化學式為________。
②“熱分解系統”中每分解1molFexOy,轉移電子的物質的量為________。
工業上用CO2和H2反應合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
則2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
①一定條件下,上述合成甲醚的反應達到平衡狀態后,若改變反應的某一個條件,下列變化能說明平衡一定向正反應方向移動的是________(填字母)。
a.逆反應速率先增大后減小 b.H2的轉化率增大
c.反應物的體積百分含量減小 d.容器中的![]() 值變小
值變小
②在某壓強下,合成甲醚的反應在不同溫度、不同投料比時,CO2的轉化率如下圖所示。T1溫度下,將6molCO2和12molH2充入2L的密閉容器中,5min后反應達到平衡狀態,則0~5min內的平均反應速率v(CH3OCH3)=__________;KA、KB、KC三者之間的大小關系為____________。

(3)常溫下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH![]() )________(填“>”、“<”或“=”)c(HCO
)________(填“>”、“<”或“=”)c(HCO![]() );反應NH
);反應NH![]() +HCO
+HCO![]() +H2O=NH3·H2O+H2CO3的平衡常數K=__________。(已知常溫下NH3·H2O的電離平衡常數Kb=2×10-5,H2CO3的電離平衡常數K1=4×10-7,K2=4×10-11)
+H2O=NH3·H2O+H2CO3的平衡常數K=__________。(已知常溫下NH3·H2O的電離平衡常數Kb=2×10-5,H2CO3的電離平衡常數K1=4×10-7,K2=4×10-11)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com