
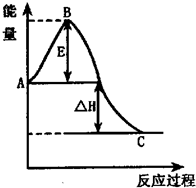
(1)已知熱化學方程式如下:N2(g)+3H2O(1)==2NH3(g)+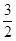 O2(g);△H="+765.2" kJ·mol-1,請在答題卡的坐標圖中,畫出上述反應過程中體系能量變化示意圖,并進行必要標注。
O2(g);△H="+765.2" kJ·mol-1,請在答題卡的坐標圖中,畫出上述反應過程中體系能量變化示意圖,并進行必要標注。
(2)明礬能凈水的原因: (用離子方程式和必要的文字解釋)
___________________________________________________________________________。
(3)已知FeCl3能水解 ,則配制FeCl3溶液的方法是 ____ 。
(4)炒過菜的鐵鍋未及時洗凈,不久便會因腐蝕而出現紅褐色銹斑。請回答:
鐵鍋的銹蝕是 腐蝕(填“析氫”或“吸氧”)
寫出鐵鍋腐蝕負極的電極反應式:
正極的電極反應式:
(1)  (2分);
(2分);
(2)因為明礬溶于水發生Al3++3H2O Al(OH)3+3H+,生成Al(OH)3膠體能吸附水中的懸浮物質。(2分)
Al(OH)3+3H+,生成Al(OH)3膠體能吸附水中的懸浮物質。(2分)
(3)將FeCl3固體溶解在濃鹽酸中,再加水稀釋至所需濃度。(2分)
(4)吸氧腐蝕(1分),2Fe-4e-=2Fe2+(2分), O2 + 2H2O + 4e-= 4OH-(2分)
解析試題分析:(1)根據反應的熱化學方程式可知,該反應是吸熱反應,所以反應物的總能量低于生成物的總能量,則圖像是(見答案)。
(2)因為明礬溶于水電離出的鋁離子發生水解反應,Al3++3H2O Al(OH)3+3H+,生成Al(OH)3膠體能吸附水中的懸浮物質,所以明礬可以作為凈水劑。
Al(OH)3+3H+,生成Al(OH)3膠體能吸附水中的懸浮物質,所以明礬可以作為凈水劑。
(3)FeCl3能水解,溶液顯酸性,所以配制FeCl3溶液的方法是將FeCl3固體溶解在濃鹽酸中,再加水稀釋至所需濃度。
(4)鋼鐵的腐蝕主要是吸氧腐蝕,其中負極是鐵失去電子,電極反應式是2Fe-4e-=2Fe2+。正極是氧氣得到電子,則電極反應式是O2 + 2H2O + 4e-= 4OH-。
考點:考查化學反應中的能量變化、明礬凈水、氯化鐵的配制以及鋼鐵的吸氧腐蝕
點評:該題是高考中的常見題型,屬于中等難度的試題。試題貼近高考,基礎性強,側重對學生基礎知識的鞏固與訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力,有利于培養學生的邏輯推理能力和規范答題能力。


 課前課后同步練習系列答案
課前課后同步練習系列答案 課堂小作業系列答案
課堂小作業系列答案 黃岡小狀元口算速算練習冊系列答案
黃岡小狀元口算速算練習冊系列答案 成功訓練計劃系列答案
成功訓練計劃系列答案 倍速訓練法直通中考考點系列答案
倍速訓練法直通中考考點系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化學 來源: 題型:

| ||
| 32V |
| 22.4W |
| 22.4V |
| 32W |
| 3(W-m) |
| W |
| 8(W-m) |
| 5W |
| 催化劑 |
| △ |
| 催化劑 |
| △ |
| 1 |
| 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解



| ||
| ||
| ||
| 高溫高壓 |
| ||
| 高溫高壓 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 充電 |
| 放電 |
| ||
| 高溫高壓 |
| 時間/min | c(N2)/mol?L-1 | c(H2)/mol?L-1 | c(NH3)/mol?L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 (2010?南昌一模)在恒溫恒容的密閉容器中通入1molN2和XmolH2,發生如下反應:N2(g)+3H2(g)
(2010?南昌一模)在恒溫恒容的密閉容器中通入1molN2和XmolH2,發生如下反應:N2(g)+3H2(g)| 催化劑 | 高溫、高壓 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 催化劑 |
| 催化劑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com