
【題目】滴定是一種重要的定量實驗方法:
Ⅰ.酸堿中和滴定:常溫下,用0.1000mol/L NaOH溶液分別滴定20.00mL 等濃度的鹽酸和醋酸溶液,得到兩條滴定曲線,如下圖所示:
(1)滴定鹽酸的曲線是圖__________(填“1”或“2”)
(2)滴定前CH3COOH的電離度為__________
(3)達到B、D狀態(tài)時,反應(yīng)消耗的NaOH溶液的體積a__________b(填“>”“<”或“=”)
Ⅱ.氧化還原滴定原理與中和滴定原理相似,為了測定某NaHSO3固體的純度,現(xiàn)用0.1000mol/L的酸性KMnO4溶液進行滴定,回答下列問題:
(1)準確量取一定體積的酸性KMnO4溶液需要使用的儀器是___________________。
(2)已知酸性KMnO4溶液的還原產(chǎn)物為MnSO4,寫出此反應(yīng)的離子方程式:_____
(3)若準確稱取WgNaHSO3固體溶于水配成500mL溶液,取25.00mL置于錐形瓶中,用KMnO4溶液滴定至終點,消耗KMnO4溶液VmL。則滴定終點的現(xiàn)象為_______NaHSO3固體的純度為_________。
(4)下列操作會導(dǎo)致測定結(jié)果偏低的是__________.
A 未用標準濃度的酸性KMnO4溶液潤洗滴定管
B 滴定前錐形瓶未干燥
C 盛裝酸性KMnO4溶液的滴定管,滴定前滴定管尖嘴部分有氣泡, 滴定后無氣泡
D 不小心將少量酸性KMnO4溶液滴在錐形瓶外
E 觀察讀數(shù)時,滴定前仰視,滴定后俯視
【答案】1 1% > 酸式滴定管 5HSO3-+2MnO4-+ H+=5SO42-+2Mn2++3H2O 溶液由無色變?yōu)樽霞t色,且半分鐘不褪色 ![]() ×100% E
×100% E
【解析】
Ⅰ.(1)CH3COOH不完全電離,HCl完全電離,使CH3COOH溶液中c(H+)比同濃度的HCl溶液中c(H+)小,pH大;滴定鹽酸的曲線是圖1,故答案為:1;
(2)根據(jù)圖1可知鹽酸溶液的起始濃度為0.1mol/L,鹽酸溶液和醋酸溶液是等濃度的,所以醋酸溶液起始濃度也為0.1mol/L,根據(jù)圖2可知醋酸溶液的起始pH=3,溶液中c(H+)=10-3mol/L,電離度α=![]() ×100%=1%,故答案為:1%;
×100%=1%,故答案為:1%;
(3)達到B、D狀態(tài)時,溶液為中性,NaCl不水解,CH3COONa水解使溶液呈堿性,為使CH3COONa溶液顯中性,需要少加一部分NaOH,使溶液中留有一部分CH3COOH,所以反應(yīng)消耗的NaOH溶液的體積a>b,故答案為:>;
Ⅱ.(1)高錳酸鉀溶液具有強氧化性,能腐蝕堿式滴定管的橡皮管,所以選用酸式滴定管量取高錳酸鉀溶液;故答案為:酸式滴定管;
(2)酸性KMnO4溶液的還原產(chǎn)物為MnSO4,+4價的硫被氧化為+6價,生成硫酸根離子,反應(yīng)的離子方程式為:5HSO3-+2MnO4-+ H+=5SO42-+2Mn2++3H2O ,故答案為:5HSO3-+2MnO4-+ H+=5SO42-+2Mn2++3H2O ;
(3)KMnO4溶液呈紫色,與NaHSO3反應(yīng),紫色褪去,滴定終點的現(xiàn)象為:滴入最后一滴KMnO4溶液,紫色不褪去;故答案為:溶液由無色變?yōu)樽霞t色,且半分鐘不褪色;
若準確稱取WgNaHSO3固體溶于水配成500mL溶液,取25.00mL置于錐形瓶中,用KMnO4溶液滴定至終點,消耗KMnO4溶液VmL。
2MnO4 ~ 5HSO3-
0.1mol/L×V×10-3L n(HSO3-)
解得 n(HSO3-)=5/2×V×10-4mol,即25.00mL溶液中NaHSO3的物質(zhì)的量為5/2×V×10-4mol,所以500mL溶液中NaHSO3的物質(zhì)的量為5×V×10-3mol,NaHSO3固體的質(zhì)量為5×V×10-3mol×104g/mol=5.2×V×10-1g,純度為![]() ×100%=
×100%= ![]() ×100%,故答案為:
×100%,故答案為:![]() ×100%;
×100%;
(4)A.未用標準濃度的酸性KMnO4溶液潤洗滴定管,標準液的濃度偏小,造成V(標準)偏大,根據(jù)c(待測)=c(標準)v(標準)/v(待測)分析,c(標準)偏大;
B.滴定前錐形瓶未干燥,待測液的物質(zhì)的量不變,對V(標準)無影響,根據(jù)c(待測)=c(標準)v(標準)/v(待測)分析,c(標準)不變;
C.滴定前滴定管尖嘴部分有氣泡,滴定后無氣泡,造成V(標準)偏大,根據(jù)c(待測)=c(標準)v(標準)/v(待測)分析,c(標準)偏大;
D.不小心將少量酸性KMnO4溶液滴在錐形瓶外,造成V(標準)偏大,根據(jù)c(待測)=c(標準)v(標準)/v(待測)分析,c(標準)偏大;
E.觀察讀數(shù)時,滴定前仰視,滴定后俯視,造成V(標準)偏小,根據(jù)c(待測)=c(標準)v(標準)/v(待測)分析,c(標準)偏小;
綜上所述,操作會導(dǎo)致測定結(jié)果偏低的是E,故選E。


科目:高中化學(xué) 來源: 題型:
【題目】右下表為元素周期表的一部分,其中X、Y、Z、W為短周期元素,W元素的核電荷數(shù)為X元素的2倍。下列說法正確的是( )
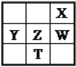
A. X、W、Z元素的原子半徑及它們的氣態(tài)氫化物的熱穩(wěn)定性均依次遞增
B. Y、Z、W元素在自然界中均不能以游離態(tài)存在,它們的最高價氧化物的水化物的酸性依次遞增
C. YX2晶體熔化、液態(tài)WX3氣化均需克服分子間作用力
D. 根據(jù)元素周期律,可以推測T元素的單質(zhì)具有半導(dǎo)體特性,T2X3具有氧化性和還原性
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】25℃時,pH簡單計算。
(1)0.05mol/L的硫酸溶液的pH=________________;0,01mol/L的NaOH溶液的pH=________________。
(2)1mlpH=2的硫酸加水稀釋至100ml,pH=___________。
(3)常溫下,由水電離出的C(H+)=1×10-12mol/L,則,該溶液的可能pH=___________。
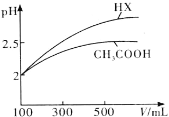
(4)體積均為100mL pH=2的CH3COOH與一元酸HX,加水稀釋過程中pH與溶液體積的關(guān)系如圖所示,則HX的電離平衡常數(shù)________(填“大于”、“小于”或“等于”)CH3COOH的電離平衡常數(shù)。
(5)常溫下,常溫下,pH=12的NaOH溶液與pH=1的HCl溶液按一定比例混合,所得溶液pH=2,則NaOH溶液與HCl溶液的體積比為_________________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】某溫度下,向一定體積 0.1mol/L 醋酸溶液中逐滴加入等濃度的NaOH溶液,溶液中pOH (pOH = -lg[OH-])與pH的變化關(guān)系如圖所示,則

A. M點所示溶液導(dǎo)電能力強于Q點
B. N點所示溶液中c(CH3COO-)﹥c(Na+)
C. M點和N點所示溶液中水的電離程度相同
D. Q點消耗NaOH溶液的體積等于醋酸溶液的體積
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】某課題組以納米Fe2O3作為電極材料制備鋰離子電池(另一極為金屬鋰和石墨的復(fù)合材料),通過在室溫條件下對鋰離子電池進行循環(huán)充放電,成功地實現(xiàn)了對磁性的可逆調(diào)控(如圖)。下列說法錯誤的是
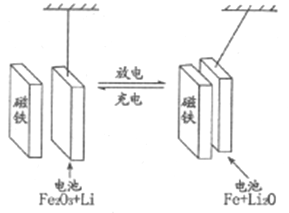
A. 放電時,負極的電極反應(yīng)式為Li-e-=Li+
B. 放電時,電子通過電解質(zhì)從Li流向Fe2O3
C. 充電時,Fe做陽極,電池逐漸擺脫磁鐵吸引
D. 充電時,陽極的電極反應(yīng)式為2Fe+3Li2O-6e-= Fe2O3+6Li+
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】下表列出了①~⑨九種元素在周期表中的位置:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ |
請按要求回答下列問題。
(1)元素④的名稱是______
(2)元素⑦的原子結(jié)構(gòu)示意圖是____________。
(3)按氣態(tài)氫化物的穩(wěn)定性由弱到強的順序排列,⑥④⑦的氫化物穩(wěn)定性:________(寫氫化物的化學(xué)式)。
(
(5)元素⑤的單質(zhì)在氧氣中燃燒所得產(chǎn)物中化學(xué)鍵的類型為_____________________
(6)用電子式表示①與⑨反應(yīng)得到的化合物的形成過程_______________。
(7)兩種均由①④⑤⑦四種元素組成的化合物,在水溶液中發(fā)生反應(yīng)的離子反應(yīng)方程式為________
(8)第三周期元素Na Mg Al S Cl 的簡單離子半徑由大到小的順序是______(用離子符號表示)
(9)已知1g①的單質(zhì)燃燒生成液態(tài)產(chǎn)物時放出142.9kJ的熱量,寫出表示該單質(zhì)燃燒熱的熱化學(xué)方程式:____________
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】據(jù)題目提供的溶度積數(shù)據(jù)進行計算并回答下列問題:
(1)在Ca(NO3)2溶液中加入(NH4)2CO3溶液后過濾,若測得濾液中c(CO32-)=10-3mol·L-1,則Ca2+是否沉淀完全?________(填“是”或“否”)。[已知c(Ca2+)≤10-5mol·L-1時可視為沉淀完全,Ksp(CaCO3)=4.96×10-9]
(2)已知25℃時,Ksp[Mg(OH)2]=4.0×10-12;酸堿指示劑百里酚藍變色的pH范圍如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
顏色 | 黃色 | 綠色 | 藍色 |
25℃時,在Mg(OH)2飽和溶液中滴加2滴百里酚藍指示劑,溶液的顏色為___________。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的鹽酸,生成沉淀。已知該溫度下AgCl的Ksp=1.0×10-10,忽略溶液的體積變化,請計算:
①完全沉淀后,溶液中c(Ag+)=__________ mol·L-1。
②完全沉淀后,溶液的pH=__________。
(4) 已知常溫下Ksp[Fe(OH)3]=1×10-39,某CuSO4溶液中含有Fe3+,可以加入_________調(diào)節(jié)溶液的pH=___________使溶液中的c(Fe3+)=10-5 mol/L除去
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】利用反應(yīng):2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.8kJmol-1,可凈化汽車尾氣,如果要同時提高該反應(yīng)的速率和NO的轉(zhuǎn)化率,采取的措施是
2CO2(g)+N2(g)△H=-746.8kJmol-1,可凈化汽車尾氣,如果要同時提高該反應(yīng)的速率和NO的轉(zhuǎn)化率,采取的措施是
A. 降低溫度 B. 及時將CO2和N2從反應(yīng)體系中移走
C. 升高溫度同時充入N2 D. 增大壓強同時加催化劑
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com