
[原料氣成分(體積分數(shù)):SO2:7%,O2:11%,N2:82%;壓強:0.1Mpa]
溫度/℃ | 400 | 450 | 500 | 525 | 550 | 575 | 600 | 650 | 1 000 |
轉(zhuǎn)化率/% | 99.2 | 97.5 | 95.8 | 93.5 | 90.5 | 85.6 | 79.9 | 73.7 | 58.5 |
SO2接觸氧化是一個放熱反應。根據(jù)化學平衡理論判斷,此反應在溫度較低的條件下最為有利。但為什么實際生產(chǎn)中,選定400—500 ℃作為操作溫度?
(2)壓強對SO2平衡轉(zhuǎn)化率的影響的有關參數(shù)如下表[原料氣成分同第(1)題]
壓強/Mpa 轉(zhuǎn)化率/% 溫度/℃ | 0.1 | 0.5 | 1 | 10 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
根據(jù)化學平衡理論,考慮綜合經(jīng)濟效益,結合表中數(shù)據(jù),分析回答為什么SO2接觸氧化在常壓下進行。
 暑假銜接教材期末暑假預習武漢出版社系列答案
暑假銜接教材期末暑假預習武漢出版社系列答案 假期作業(yè)暑假成長樂園新疆青少年出版社系列答案
假期作業(yè)暑假成長樂園新疆青少年出版社系列答案科目:高中化學 來源: 題型:

| 1 |
| 2 |
| 催化劑 |
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| CO |
| 高溫 |
| 稀硫酸 |
| 稀硫酸 |
| 鐵屑 |
| 鐵粉 |
| 高溫 |
| 稀硫酸 |
| H2 |
| 高溫 |
| 硫酸銅溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 溫度(℃) | 25 | t1 | t2 |
| 水的離子積常數(shù) | 1×10-14 | α | 1×10-13 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 溫度/℃ | 25 | t1 | t2 |
| 水的離子積常數(shù) | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
科目:高中化學 來源:高考三人行 化學 題型:043
(1)下表是不同溫度下SO2的平衡轉(zhuǎn)化率.[原料氣成分(體積分數(shù));SO2 7%,O2 11%,N2 82%;壓強;0.1MPa]
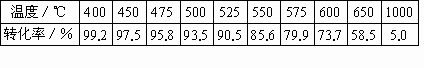
SO2接觸氧化是一個放熱反應.根據(jù)化學平衡理論判斷,此反應在溫度較低的條件下進行最為有利.但為什么實際生產(chǎn)中,選定400℃~500℃作為操作溫度?
(2)壓強對SO2平衡轉(zhuǎn)化率的影響[原料氣成分同第(1)題]
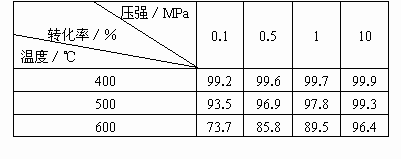
根據(jù)化學平衡理論,考慮綜合經(jīng)濟效益,結合表中數(shù)據(jù),分析回答為什么SO2接觸氧化在常壓下進行?
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com