
分析 (1)用K35ClO3和濃H37Cl反應制取氯氣,反應的方程式為K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O,K35ClO3中氯原子化合價降低做氧化劑生成還原產物,6H37Cl中有5H37Cl的氯原子化合價升高做還原劑生成氧化產物,再根據氯原子守恒,生成的Cl2中,35Cl與37Cl個數比為1:5,然后根據摩爾質量與相對分子質量在數值上相等,據此分析;
(2)根據氧化還原反應中化合價變化及質量守恒定律判斷反應物和生成物,并配平反應方程式、判斷還原產物.
解答 解:(1)用K35ClO3和濃H37Cl反應制取氯氣,反應的方程式為K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O,K35ClO3中氯原子化合價降低做氧化劑生成氯氣為還原產物,6H37Cl中有5H37Cl的氯原子化合價升高做還原劑生成氯氣為氧化產物,所以氧化產物與還原產物物質的量之比是5:1,再根據氯原子守恒,生成的Cl2中,35Cl與37Cl個數比為1:5,所以得到氯氣的摩爾質量是$\frac{35×1+37×5}{3}$=73.3g/mol,又K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O,反應生成3mol氯氣轉移5mol電子,所以產生71.00g的氯氣電子轉移數目為$\frac{71}{73.3}$×$\frac{5}{3}$=1.6mol即1.6NA,
故答案為:K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O;Cl2;Cl2;5:1;73.3g/mol;1.6NA;
(2)由氧化還原反應中化合價升降相等進行配平:鎳元素的化合價降低了2價,磷元素的化合價升高的2價,所以根據原子守恒結合電荷守恒可得配平的方程式為:H2O+Ni2++H2PO2-+═Ni+H2PO3-+2H+,
故答案為:1;1;H2O;1;1;2H+.
點評 本題考查了氧化還原反應,明確反應中元素的化合價變化及原子守恒為解答的關鍵,題目難度不大.


 輕巧奪冠周測月考直通中考系列答案
輕巧奪冠周測月考直通中考系列答案科目:高中化學 來源: 題型:選擇題
| A. | 二氧化碳可用于滅火 | |
| B. | 可用pH試紙測定溶液酸堿度 | |
| C. | 可用灼燒的方法鑒定羊毛、合成纖維 | |
| D. | 稀釋濃硫酸時可將水倒入盛有濃硫酸的燒杯中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可以用氯水鑒別AgNO3、Al2(SO4)3、CuSO4溶液 | |
| B. | 石油分餾可獲得乙烯、丙烯和丁二烯 | |
| C. | 電解質在熔化狀態下不一定能導電 | |
| D. | 用核磁共振氫譜可鑒定未知物C2H6O的分子結構 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
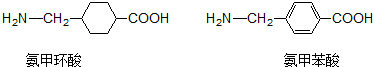
| A. | 氨甲環酸、氨甲苯酸都能發生取代、氧化、加聚、加成等反應 | |
| B. | 氨甲環酸、氨甲苯酸中都有5種不同的氫原子 | |
| C. | 氨甲環酸與氨甲苯酸互為同分異構體 | |
| D. | 氨甲環酸、氨甲苯酸都能與NaOH溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 空玻璃管 | 實驗前(樣品+玻璃管) | 實驗后(樣品+玻璃管) |
| 59.60g | 65.60g | 64.64g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | O2與O4屬于同素異形體 | B. | H2與H4屬于同位素 | ||
| C. | C60的質量數為 720 g/mol | D. | N5+中含有36個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com