
在恒容恒溫條件下,能使可逆反應A(g)+B(g)==C(g)+D(g)正反應速率
增大的措施是 (g表示氣體狀態) ( )
A. 減少C或D的濃度 B. 增大D的濃度
C. 減少B的濃度 D. 增大A或B的濃度
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:閱讀理解

| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年江蘇省揚州市高二下學期期末考試化學試卷(帶解析) 題型:填空題
我國有豐富的天然氣資源。以天然氣為原料合成尿素的主要步驟如下圖所示(圖中某些轉化
步驟及生成物未列出):
(1)“造合成氣”發生的熱化學方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0在恒溫恒容的條件下,欲提高CH4的反應速率和轉化率,下列措施可行的是 。
CO(g)+3H2(g);△H>0在恒溫恒容的條件下,欲提高CH4的反應速率和轉化率,下列措施可行的是 。
A、增大壓強 B、升高溫度 C、充入He氣 D、增大水蒸氣濃度
(2)“轉化一氧化碳”發生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化學 來源:2014屆江蘇省揚州市高二下學期期末調研測試化學試卷(解析版) 題型:填空題
我國有豐富的天然氣資源。以天然氣為原料合成尿素的主要步驟如下圖所示(圖中某些轉化步驟及生成物未列出):

(1)“造合成氣”發生的熱化學方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒溫恒容的條件下,欲提高CH4的反應速率和轉化率,下列措施可行的是 。
A、增大壓強 B、升高溫度 C、充入He氣 D、增大水蒸氣濃度
(2)“轉化一氧化碳”發生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
|
溫度/℃ |
400 |
500 |
800 |
|
平衡常數K |
9.94 |
9 |
1 |
提高氫碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不變”或“減小”);若該反應在400℃時進行,起始通入等物質的量的H2O和CO,反應進行到某一時刻時CO和CO2的濃度比為1∶3,此時v(正) v(逆)(填“>”、“=”或“<”)。
(3)有關合成氨工業的說法中正確的是 。
A、該反應屬于人工固氮
B、合成氨工業中使用催化劑能提高反應物的利用率
C、合成氨反應溫度控制在500℃左右,目的是使化學平衡向正反應方向移動
D、合成氨工業采用循環操作的主要原因是為了加快反應速率
(4)生產尿素過程中,理論上n(NH3)∶n(CO2)的最佳配比為 ,而實際生產過程中,往往使n(NH3)∶n(CO2)≥3,這是因為 。
(5)當甲烷合成氨氣的轉化率為60%時,以3.0×108 L甲烷為原料能夠合成 L 氨氣。(假設體積均在標準狀況下測定)
查看答案和解析>>
科目:高中化學 來源:2014屆江蘇省揚州市高二下學期期末考試化學試卷(解析版) 題型:填空題
我國有豐富的天然氣資源。以天然氣為原料合成尿素的主要步驟如下圖所示(圖中某些轉化
步驟及生成物未列出):
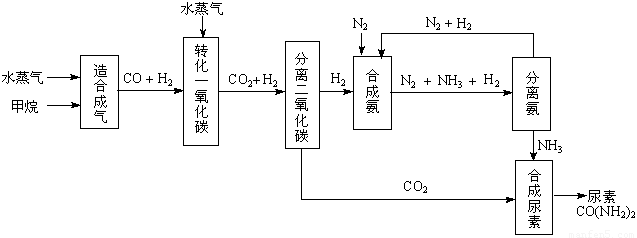
(1)“造合成氣”發生的熱化學方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0在恒溫恒容的條件下,欲提高CH4的反應速率和轉化率,下列措施可行的是 。
CO(g)+3H2(g);△H>0在恒溫恒容的條件下,欲提高CH4的反應速率和轉化率,下列措施可行的是 。
A、增大壓強 B、升高溫度 C、充入He氣 D、增大水蒸氣濃度
(2)“轉化一氧化碳”發生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
|
溫度/℃ |
400 |
500 |
800 |
|
平衡常數K |
9.94 |
9 |
1 |
提高氫碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不變”或“減小”);若該反應在400℃時進行,起始通入等物質的量的H2O和CO,反應進行到某一時刻時CO和CO2的濃度比為1∶3,此時v(正) v(逆)(填“>”、“=”或“<”)。
(3)有關合成氨工業的說法中正確的是 。
A、該反應屬于人工固氮
B、合成氨工業中使用催化劑能提高反應物的利用率
C、合成氨反應溫度控制在500℃左右,目的是使化學平衡向正反應方向移動
D、合成氨工業采用循環操作的主要原因是為了加快反應速率
(4)生產尿素過程中,理論上n(NH3)∶n(CO2)的最佳配比為 ,而實際生產過程中,往往使n(NH3)∶n(CO2)≥3,這是因為 。
(5)當甲烷合成氨氣的轉化率為60%時,以3.0×108 L甲烷為原料能夠合成 L 氨氣。(假設體積均在標準狀況下測定)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com