
【題目】用40gNaOH固體溶于水配制成250ml溶液,此溶液的物質的量濃度是____,取該溶液10ml,再加水稀釋成100ml時,所得稀溶液的物質的量濃度為___,在這100ml溶液中含____g。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】含C、N化合物在生產、生活中有著重要的作用。請按要求回答下列問題。
N在元素周期表中的位置:______________。
元素C、N最簡單氣態氫化物的穩定性強弱比較(填化學式): ____________.
I.氨氣應用于侯德榜制堿工藝,原理如下圖所示:
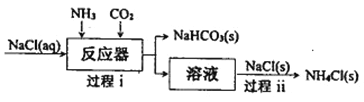
(1)過程i通入NH3和CO2的順序是___________。
(2)過程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制堿副產品NH4Cl可用于生產NH3和HCl。但直接加熱分解NH4Cl, NH3和HCl的產率很低,原因是(用化學方程式表示)_________________。 而采用在N2氛圍中,將MgO與NH4Cl混合加熱至300℃,可獲得高產率的NH3,該反應的化學方程式為____________。
Ⅱ.電鍍工業中含CN-的廢水在排放前的處理過程如下:
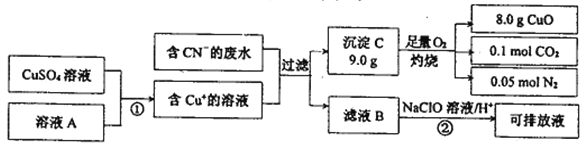
(1)溶液A具有的性質是(填“氧化性”或“還原性”) _______. C的化學式為:______。
(2)反應② 可將CN一轉化為無害物質,其離子方程式為:_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室要用CuSO4·5H2O晶體配制500 mL 0.1 mol·L-1 CuSO4溶液,回答下列問題:

(1)應該用托盤天平稱取CuSO4·5H2O________g。
(2)如圖Ⅰ表示10 mL量筒中液面的位置,A與B,B與C刻度間相差1 mL,如果刻度A為8,量筒中液體的體積是________mL。
(3)若實驗中如圖Ⅱ所示的儀器有下列情況,對配制溶液的濃度有何影響?(填“偏高”“偏低”或“無影響”)
A.定容前容量瓶底部有水珠__________________________;
B.定容時加水超過刻度線____________________________;
C.最終定容時俯視觀察液面__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是:
A. 氫氧化鋁與稀硝酸反應:H+ + OH- = H2O
B. MgCl2溶液與氨水反應: Mg2+ + 2NH3·H2O = Mg(OH)2↓+2NH![]()
C. CuCl2溶液與鐵粉反應: 3Cu2+ + 2Fe =3Cu + 2Fe3+
D. 鋅與CH3COOH溶液反應:Zn + 2H+ = Zn2++ H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋是生命的搖籃,海水不僅是寶貴的水資源,而且蘊藏著豐富的化學資源。
I.(1)海水中所得粗鹽中通常含Ca2+、Mg2+、SO42-等雜質,為了得到精鹽,下列試劑加入的先后順序正確的是________
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)為了檢驗精鹽中是否含有SO42-,正確的方法是____________________________。
II.海藻中提取碘的流程如圖所示
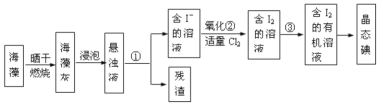
(1)灼燒過程中,需使用到的(除泥三角外)實驗儀器有______
A.試管 B.瓷坩堝 C.坩堝鉗 D.蒸發皿 E.酒精燈 F.三腳架
(2)指出提取碘的過程中有關實驗操作名稱:①________③__________④_________
(3)步驟②反應的離子方程式為___________________,該過程氧化劑也可以用H2O2,將等物質的量的I-轉化為I2,所需Cl2和H2O2的物質的量之比為__________
(4)下列關于海藻提取碘的說法,正確的是_________
A.含碘的有機溶劑呈現紫紅色
B.操作③中先放出下層液體,然后再從下口放出上層液體
C.操作④時,溫度計的水銀球應伸入液面以下但不能觸碰到蒸餾燒瓶的底部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含有下列鍵型的物質,可能為單質的是
A.只有離子鍵的物質B.既有離子鍵,又有非極性鍵的物質
C.既有極性鍵,又有離子鍵的物質D.只有非極性鍵的物質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】質量比為1:1的CO和H2組成的混合氣體2.1 g在足量的氧氣中點燃充分反應后,將產物立即通入足量的Na2O2固體中,固體質量增加為
A. 3.6 g B. 2.1g C. 7.2 g D. 無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂和鋁的堿式碳酸鹽是中和胃酸藥物的主要成分。欲測定某種鎂和鋁的堿式碳酸鹽的成分進行了以下實驗,根據以下實驗記錄,回答下列問題:
(1)稱取6.02g該堿式碳酸鹽,加入4.0mol/L鹽酸使其溶解,當加入42.5mL時開始產生CO2,當加入鹽酸至45.0mL時恰好完全溶解,該堿式碳酸鹽中OH-與CO32- 的物質的量之比n(OH-)︰n(CO32-)=__________;
(2)在上述堿式碳酸鹽恰好完全溶解所得溶液中加入過量的NaOH溶液,過濾,干燥(不分解)后得3.48g沉淀物。若該堿式碳酸鹽中鎂元素與氫元素的質量分數之比為6:1,試計算確定該堿式碳酸鹽的化學式 __________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2是自然界碳循環中的重要物質。下列過程會引起大氣中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃燒 D. 碳酸鹽的沉積
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com